Tehnologia industrială modernă pentru producția de alcool etilic din materii prime alimentare include următoarele etape:
§ Pregătirea și sfărâmarea materiilor prime amidonate - boabe (în primul rând - secară, grâu), cartofi, porumb etc.
§ Fermentarea. În acest stadiu, are loc degradarea enzimatică a amidonului la zaharuri fermentabile. În aceste scopuri se utilizează preparate recombinante de alfa-amilază, obținute prin bioindustrializare - glucilasă, amilosubtilină.
§ Fermentarea. Datorită fermentației de drojdie a zaharurilor, în băutură are loc o acumulare de alcool.
§ Bragorektifikatsiya. Se efectuează pe coloanele de accelerare.
Deșeurile de fermentație sunt bioxidul de carbon, bard, fracțiunea eter-aldehidă, alcoolul fusel și uleiurile fusel.
Productivitatea unei distilerii moderne este de aproximativ 30 000-100 000 de litri de alcool pe zi.
La scară industrială, alcoolul etilic se obține dintr-o materie primă care conține celuloză (lemn, paie), care este pre-hidrolizată. Amestecul rezultat de pentoză și hexoză este supus fermentării alcoolice. În țările occidentale și americane această tehnologie nu a devenit răspândită, însă în URSS (în prezent în Rusia) a existat o industrie dezvoltată de drojdie de hidroliză furajeră și etanol hidrolitic.
În industrie, împreună cu prima metodă, este utilizată hidratarea etilenei. Hidratarea se poate face în două moduri:
§ hidratarea directă la o temperatură de 300 ° C, presiune 7 MPa, acidul ortofosforic aplicat pe silicagel, carbon activ sau azbest este utilizat ca catalizator:
§ hidratarea prin etapa intermediară a acidului sulfuric, urmată de hidroliza sa (la o temperatură de 80-90 ° C și o presiune de 3,5 MPa):
Această reacție este complicată prin formarea de eter dietilic.
Etanolul, obținut prin hidratarea etilenei sau prin fermentație, este un amestec apă-alcool conținând impurități. Curățarea este necesară pentru aplicațiile sale industriale, alimentare și farmacopee. Destilarea fracțională permite producerea de etanol cu o concentrație de aproximativ 95,6% (în greutate); acest amestec azeotrop nedivizat conține 4,4% apă (în greutate) și are un punct de fierbere de 78,15 ° C
Distilarea eliberează etanol din fracțiunile volatile și grele ale materiei organice (fundul).
Alcoolul absolut este alcoolul etilic, practic fără apă. Se fierbe la o temperatură de 78,39 ° C, în timp ce alcoolul rectificat care conține nu mai puțin de 4,43% apă se fierbe la 78,15 ° C Se obține prin distilarea unui alcool apos care conține benzen și alte metode.
Aspect: în condiții normale este un lichid volatil incolor, cu miros caracteristic și gust de ardere. Alcoolul etilic este mai ușor decât apa. Este un solvent bun pentru alte substanțe organice. Ar trebui să evite o greșeală populară: adesea amestecă proprietățile de alcool 95,57% și absolutizate. Proprietățile lor sunt aproape identice, dar valorile încep să difere, începând cu a treia - a cincea cifră semnificativă.
Interacționează cu metale alcaline pentru a forma etilați (sau, în general, alcoolați) și hidrogen.
Reacționează cu acizi carboxilici pentru a forma esteri:
Se deshidratează în prezența acidului sulfuric (la 120 ° C) pentru a forma eter dietilic:
Arde în aer și în oxigen cu eliberare de căldură:
Interacționează cu hidruri și hidroxizi ai metalelor alcaline cu formarea de etilați:
Reacționează cu hidrohalogenație în prezența clorurii de zinc:
Etanolul poate fi folosit drept combustibil în t h pentru motoarele de rachete (de exemplu, etanolul este utilizat drept combustibil în primul serial de rachete balistice din lume - german „2-V“) .., motor cu ardere internă, în forma sa pură. Limitată datorită higroscopicității sale (exfoliate), este utilizată într-un amestec cu combustibili lichizi clasici de petrol. Folosit pentru a genera componente combustibile și benzină de înaltă calitate - Etil t-butil eter, o nefosile organic decât MTBE.
§ servește ca materie primă pentru obținerea mai multor substanțe chimice cum ar fi acetaldehidă, dietil eter, plumb tetraetil, acid acetic, cloroform, acetat de etil, etilenă etc .;
§ este utilizat pe scară largă ca solvent (în industria vopselelor și lacurilor, în producția de produse chimice de uz casnic și în multe alte domenii);
§ este o componentă a mașinii de spălat antigel și de spălare a parbrizului;
§ în produsele chimice de uz casnic, etanolul este utilizat în curățarea și detergenții, în special pentru îngrijirea sticlei și a instalațiilor sanitare. Este un solvent pentru repellente.
§ În efectul său, alcoolul etilic poate fi atribuit antisepticelor;
§ ca agent dezinfectant și agent de uscare, în exterior;
§ Proprietățile de uscare și tăbăcire ale alcoolului etilic 96% sunt utilizate pentru tratamentul câmpului de operare sau în anumite metode de tratare a mâinilor chirurgului;
§ un solvent pentru medicamente, pentru prepararea de perfuzii, extracte din materii prime vegetale etc .;
§ conservarea tincturilor și extractelor (concentrație minimă 18%);
§ Defoamer în aprovizionarea cu oxigen, ventilație artificială;
§ în comprese de încălzire;
§ pentru răcirea fizică cu febră (pentru măcinare) [3];
§ o componentă a anesteziei generale în situația lipsei de medicamente;
§ ca defoamer pentru umflarea plămânilor sub formă de inhalare de soluție 33%;
§ etanolul este un antidot pentru intoxicații cu alcooli toxici, cum ar fi metanolul și etilenglicolul. Acțiunea sa se datorează faptului că fermentalkogoldegidrogenaza, atunci când există mai multe substraturi (de exemplu, metanol și etanol) realizează o oxidare competitivă, care după timp (aproape imediat, urmat de metanol / etilenglicol) ore etanol reduce concentrația actuală de metaboliți toxici (metanol - formaldehidă și acid formic, pentru acidul etilen glicol-oxalic) [4].
Parfumuri și produse cosmetice
Este un solvent universal de diferite substanțe și componenta principală a parfumurilor, Odicolone, aerosoli și m. P. O parte dintr-o varietate de mijloace, incluzând chiar și cum ar fi pastele de dinți, șampoane, duș și altele. D.
Solvent pentru aromele alimentare. Poate fi folosit ca conservant pentru produsele de panificație, precum și pentru industria de cofetărie. [6]
Înregistrat ca supliment alimentar E1510 [7].
Valoarea energetică a etanolului este de 7,1 kcal / g.
Formaldehida (din forma latină # 299; ca "furnică") este un gaz incolor, cu un miros înțepător, ușor solubil în apă, alcooli și solvenți polari. Iritant, toxic.
Formaldehida este primul membru al seriei omoloage de aldehide alifatice, formaldehidă aldehidă.
Datorită densității scăzute a electronilor la atomul de carbon, formaldehida reacționează cu ușurință chiar și cu nucleofili slabi. Aceasta, în special, explică faptul că, în soluții apoase, formaldehida este într-o formă hidratată.
Formaldehida intră în toate reacțiile caracteristice aldehidelor alifatice. În special, în reacția cu nucleofili și reactivi reducători.
Principala metodă industrială de obținere a formaldehidei este oxidarea metanolului:
Oxidarea metanolului în formaldehidă se efectuează utilizând un catalizator de argint la 650 ° C și o presiune atmosferică. Acesta este un proces tehnologic bine prelucrat, iar 80% din formaldehidă este obținută tocmai prin această metodă. Recent, a fost dezvoltată o metodă mai promițătoare bazată pe utilizarea catalizatorilor de fier-molibden. Reacția se efectuează la 300 ° C. În ambele procese, conversia este de 99% [1].
Procesul de dehidrogenare a metanolului, realizat pe catalizatori de zinc-cupru la 600 ° C, nu a fost încă dezvoltat pe scară largă, dar este foarte promițător deoarece permite producerea de formaldehidă fără apă.
Există, de asemenea, o metodă industrială de obținere a formaldehidei prin oxidarea metanului:
Procedeul se efectuează la o temperatură de 450 ° C și o presiune de 1-2 MPa, ca catalizator se utilizează fosfat de aluminiu AlPO4.
Siguranță și proprietăți toxice
Formaldehida se formează în organism prin oxidarea metanolului.
Are toxicitate, afectează negativ materialul genetic, organele reproducătoare, tractul respirator, ochii, pielea. Are un efect puternic asupra sistemului nervos central.
Concentrația maximă admisă (MPC) a formaldehidei: [2] [3] [4]
§ MPC.r. = 0,5 mg / m³
§ MPCm.r. = 0,035 mg / m³
§ ПДКс.с. = 0,003 mg / m³
Doza letală de soluție apoasă 35% de formaldehidă (formalină) este de 10-50 g.
Soluția apoasă de formaldehidă - formalina - cauzează denaturarea proteinelor, de aceea este folosit ca agent de tăbăcire în prelucrarea pieilor și gelatina de bronzare la proizvodstvekinofotoplonki. Din cauza efectului puternic de tăbăcire formaldehidă este, de asemenea, un antiseptic puternic, este proprietatea formol este utilizat în medicină ca antiseptic (Formidronum, Formagel și medicamente similare), precum și pentru conservarea materialelor biologice (crearea de medicamente anatomice și alte).
Cea mai mare parte de formaldehidă se duce la fabricarea polimerilor, termoplaste (fenol-formaldehidă și melamină formaldehidă rășini karbamidformaldenidnye), este de asemenea utilizat pe scară largă în sinteza organică industriale (pentaeritritol, trimetilolpropan etc.).
Formaldehida este bună. în apă, alcooli și alți radiatori polari. La miscibile cu m pax scăzut în toate proporțiile cu nepolar p-ERATOR: toluen, eter dietilic, acetat de etil, CHCl3 (cu creșterea t-ry picături p-rimost) nu sol. în eter de petrol. Curatireape ry conține un amestec de echilibru formaldehidă monohidrat CH2 (OH) 2 (99,9%), instabil în Svob. stat și polimeri polimerici HO (CH2O) nH (n = 2-8), cristalini stabili. compuși. Cu continuați. depozitarea iazurilor de apă (în special la temperaturi scăzute) și atunci când acestea sunt concentrate, gradul de polimerizare este crescut. Pentru a depozita formaldehidă formaldehidică, acestea sunt stabilizate cu metanol (vezi Formalin). Evaporarea p-șanț apos în obrazuetsyaparaform vid sau ghidul paraformalde (CH2 O) n (n = 8-12), sub acțiunea alcalii pe conc. plante de apă - așa-numitele. a-polioximetilen (n> 100). Polimerizarea într-un solvent apolar conduce la poliformaldehidă (n> 1000).
Paraform - impotent. cristale cu un miros de formaldehidă, t. pl. 120-170 ° C, în apă rece este reciclat lent, în apă caldă rapid, formând formule de formaldehidă, solubilitate scăzută. în acetonă; inflamabil, vol. 72 0 C.
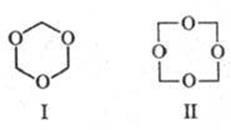
Cunoscut ciclic. polimerii de formaldehidă: trioxan (formula I, punct de topire 64 ° C), obținut prin distilarea formaldehidei apoase 60% cu dec. H2S04. și tetraoximetilen (formula II, punct de topire 112 ° C), care se formează în timpul încărcării. diacetat cu masă moleculară mare. POM.
Formaldehida are o reactivitate ridicată. H2 este restabilit în prezență. multe metale sau oxizii lor (de exemplu, Ni, Pt, Cu) până la metanol; oxidată cu HNO3. KMnO4 la acid formic sau CO2 și H20; asediați de mulți. metale (Ag, Pt, Au, Bi etc.) din râurile sărurilor lor, în timp ce se oxidează în același timp într-o formă de furnică.
Cu prezența aldehidelor. formaldehidă alcalină puternică intră în așa-numita. secțiune transversală Cannizzaro (C6H5CHO + HCHO C6H5CH2OH + HCOONa); cu acetaldehidă în prezență. Ca (OH) 2 formează pentaeritritol, în faza de vapori la 285 ° C - acroleină; sub influența alcoolaților Al sau Mg, formaldehida este disproporționată pentru a forma metiltiomatul (vezi reacția Tishchenko).
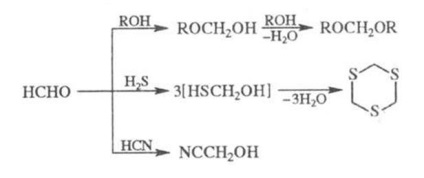
P-formaldehidă cu prezența alcoolilor. k-t puternice duce la acetal (formal), cu H2S - la ciclic. tritiu, cu HCN prezent. alcali - cyanhidrin:
Formaldehida se alătură olefinelor în prezență. catalizatori acizi, pentru a forma 1,3-diglicol și 1,3-dioxani (vezi. reacția Prins), p-TION formaldehidei cu izopren izobutilenă dă, cu faza de propilenă lichidă de condensare în prezența. BF3 sau H2S04 este butadienă. Din formaldehidă și keten în industrie, se obține b-propiolactona.
P-formaldehidă cu acetilenă - prom. o metodă de producere a butadienei (a se vedea reacția Repep), cu o metodă reciprocă. două molecule de formaldehidă cu formă acetilenică 2-butin-1,4-diol.
În prezența. Formaldehida este transformată în carbohidrați:
Atunci când sunt reciproc. formaldehidă cu NH3 formată hexametilentetramină, cu amine primare - trimerii, cu bis (di-alchilamino) metani secundari:
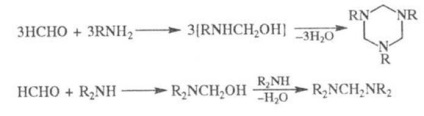
Conn. cu un atom de hidrogen mobil reacționează cu formaldehidă și NH3 (sau amine) prin reacția Mannich. P-formaldehidă cu NH4CI prom. o metodă pentru prepararea metilamină: 2HOCO + NH4CICH3NH2 · HCI + HCOOH (p-tionarea poate merge mai departe cu formarea di- și trimetilaminelor). Cu uree formaldehidă în condiții alcaline conferă dimetilolnye mono- și derivați ai acestora la rășini ureo-formaldehidice preparat-ryh policondensare și izmelamina formaldegida- și rășini melamin formaldehidice.
Propilen (propen) CH2 = CH-CH3 - hidrocarbură nesaturată (nesaturată) a unei serii de etilenă, gaz combustibil. Medicamentul cu efect narcotic este mai puternic decât cel al etilenelor. Clasa de pericol este a patra. [1].
Propilen este o substanță gazoasă, cu punct de fierbere scăzut p.f. = -47,7 ° C și un punct de topire punct topire = -187,6 ° C, densitatea optică a 4 d20 = 0.5193.
Are o reactivitate semnificativă. Proprietățile sale chimice sunt determinate de o dublă legătură carbon-carbon. p-bond ca cel mai durabil și mai accesibile, în timp ce acțiunea reactivului este rupt și eliberați atomii de carbon de valență sunt cheltuite pe care unește atomii care formează molecula de reactant. Toate reacțiile de adiție se realizează printr-o dublă legătură și constau în scindarea legăturii π a alchenului și formarea a două noi # 963; - conexiuni.
Adesea, reacțiile de adiție se desfășoară prin tip heterolitic, fiind reacțiile de adăugare electrofilă.
Adăugarea de halogeni (halogenare)
Reacția de halogenare este de obicei efectuată într-un solvent la temperatura obișnuită. Halogenii sunt ușor atașați la punctul în care dubla legătură se rupe pentru a forma derivați dihalogeni. Mai ușor este adăugarea de clor și brom, mai dificil - iod. Fluorul interacționează cu explozia.
] Adăugarea de hidrogen (reacție de hidrogenare)
Prin adăugarea de hidrogen în prezența catalizatorilor (Pt, Pd, Ni), propenul trece în hidrocarbura-propan final.
Adăugarea de apă (reacția de hidratare)
Propilenul reacționează cu apă pentru a forma un alcool monohidric de izopropanol, cu dubla legătură fiind deschisă.
Adăugarea hidrogenului halogenat (HHal)
Se întâmplă după regula lui Markovnikov. Hidrogenul acidului HHal este atașat la atomul de carbon cel mai hidrogenat într-o dublă legătură. În consecință, restul Hal este legat la un atom de carbon la care se află un număr mai mic de atomi de hidrogen.

Un exemplu de hidrohalogenare este prepararea unui derivat de brom de propan în timpul reacției de bromură de hidrogen și propilenă.
Vezi deasemenea: Halogenarea cu hidrogen a alchenelor
Combustia în aer
Când este aprins, arde în aer: 2CH2 = CHCH3 + 9O2 → 6CO2 + 6H2O.
Cu oxigenul în aer, propilena gazoasă formează amestecuri explozive.
În propilenă mediu apos neutru sau slab alcalin este oxidat cu permanganat de potasiu, care este însoțită de decolorarea și formarea de glicoli de soluție KMnO4 (compuși cu două grupe hidroxil la atomi de carbon adiacenți). Această reacție a fost numită reacția Wagner.
Condiții de reacție: încălzire, prezența catalizatorilor. Combinația de molecule are loc prin împărțirea legăturilor π-intramoleculare și formarea de noi intermoleculare # 963; - Conexiuni.
Articole similare
Trimiteți-le prietenilor: