Formarea unei faze solide (cristalizarea) este un proces complex, constând în mai multe etape.
1. Deshidratarea ionilor care formează un precipitat. Ioniile din soluție sunt hidratate, faza solidă în multe cazuri nu conține apă, prin urmare ionii trebuie să piardă apă hidratată înainte de formarea cristalelor.
2. Formarea centrelor primare de cristalizare. Doi ioni de semn opus, uniți într-o moleculă, nu formează încă o formă cristalină. Formarea cristalului primar trece printr-o serie de etape intermediare. Astfel, atunci când sulfatul de bariu este precipitat din soluții suprasaturate, apar următoarele procese:
Ba 2+ + SO 4 2- ↔ Ba 2+ SO 4 2- - formarea unei perechi de ioni;
Aceasta este așa-numita perioadă de inducție.
Astfel, pentru formarea cristalului primar în orice punct al soluției, cel puțin câțiva ioni ai semnului opus trebuie să fie uniți împreună. Doar în acest caz se poate forma un prim cristalin (făt), de exemplu, dintr-o formă cubică.
3. Creșterea centrelor primare de cristalizare datorată depunerii unui număr din ce în ce mai mare de ioni, ceea ce duce la formarea de cristale de dimensiuni mai mari, care se combină în agregate mai mari, dar încă nu se pot separa de soluție ca un precipitat. Aceasta este etapa coloidală a formării unui compus insolubil.
4. Formarea timp de ceva timp în soluția de astfel de cristale mari sau agregatele lor. că nu mai pot ține în soluție și, în final, se eliberează o fază solidă (precipitat).
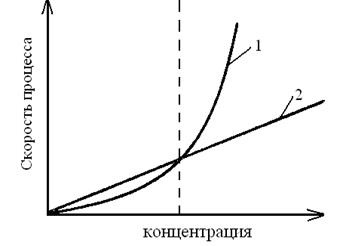
Fig. 3.1. Dependența ratelor de nucleare (1)
și creșterea lor (2) de la suprasaturatura relativă
Precipitatiile formate pot diferi in proprietatile lor. În unele cazuri, există precipitații amorfe, în altele - precipitații cristaline.
Natura sedimentului depinde de raportul dintre ratele celor două procese: rata de formare a nucleelor - centrele primare de cristalizare 1 și rata de creștere a dimensiunii embrionilor # 965; sens # 965; 1 și 2 sunt determinate de suprasaturatura relativă care apare atunci când se adaugă o soluție de precipitare.
O măsură de suprasaturație a unei soluții este gradul suprasaturației R, care este determinat de expresia:
unde C este concentrația substanței precipitate, care se obține când se introduce precipitantul;
S este solubilitatea de echilibru a precipitatului în condițiile date
De obicei, pentru valori mici ale suprasaturării relative # 965; 2> În timp ce viteza crește, ambele procese devin egale la o anumită clipă de timp și, în final, viteza # 965; 1 începe să prevaleze, adică, 2 devine mai mică # 965;
În Fig. 3.1 că pentru valorile mici ale suprasaturării relative (partea stângă a figurii), rata de creștere a embrionilor predomină, iar pentru valorile mari (partea dreaptă a figurii) predomină ritmul de formare a embrionilor noi.
Dependențele considerate explică de ce în unele cazuri se formează amorf, iar în altele se formează precipitații cristaline.
Atunci când se adaugă o soluție de precipitare, se formează o soluție suprasaturată dintr-o substanță puțin solubilă în prima perioadă a timpului. Dacă substanța este ușor solubilă, atunci se obține o suprasaturație relativă mare și rata de nucleare este mult mai mare decât rata de creștere a acesteia. În aceste condiții, cu adăugarea de porțiuni ulterioare ale soluției de precipitare, se formează un număr mare de noi centre de cristalizare. Aceste embrioni primari se reunesc în agregate mai mari și se eliberează din soluție ca un precipitat amorf.
Dimpotrivă, dacă solubilitatea substanței nu este foarte mică, suprasaturația relativă este mai mică decât în primul caz și, după adăugarea soluției de precipitare, se formează relativ puțini embrioni, ale căror dimensiuni cresc rapid. Cristale separate de dimensiuni destul de considerabile sunt izolate din soluție - se formează un precipitat cristalin.
Amplasările sedimentare amoroase constau dintr-un set de cristale foarte mici, conectate foarte slab. Majoritatea acestor precipitate au o structură cristalină și, prin urmare, se numesc și criptocristaline.
Gradul de suprasaturare a soluției poate fi modificat prin ajustarea condițiilor de precipitare.
Un precipitat cristalin gros are avantaje față de un precipitat fin cristalin și mai ales amorf. Condițiile precipitării sale pot fi determinate din gradul de suprasaturare a soluției: pentru a forma un precipitat cristalin, este necesar să se reducă gradul de suprasaturare a R.
Conform formulei (3.1), pentru a reduce R, este necesară reducerea concentrației substanței precipitate (C) și creșterea solubilității sale (S).
Reducerea concentrației compusului precipitat poate fi obținută:
1) diluarea soluției;
2) o scădere a concentrației precipitantului (metoda "reactivului emergent"): o substanță este introdusă în soluție, care, cu o reacție adecvată, de regulă, procedând la viteză mică, eliberează agentul de precipitare în soluție.
Creșterea solubilității precipitatului în timpul precipitării se realizează prin creșterea temperaturii sau prin adăugarea de electroliți care măresc efectul de sare.
Caracteristica cea mai importantă a precipitațiilor amorfe este o suprafață generală foarte mare. În acest sens, substanțele străine sunt adesea adsorbite pe suprafața sedimentelor amorfe. În plus, datorită prezenței unui număr mare de agregate foarte mici, care sunt relativ libere între ele, în timpul spălării precipitările amorfe pot forma soluții coloidale.
Articole similare
Trimiteți-le prietenilor: