Fenomenele electrice au devenit cunoscute mai întâi de om într-o formă formidabilă de trăsnet - evacuări ale electricității atmosferice, apoi electricitatea a fost descoperită și studiată, obținută prin frecare (de exemplu, piele pe sticlă etc.); În cele din urmă, după descoperirea surselor chimice de curent (celule galvanice în 1800), ingineria electrică a apărut și sa dezvoltat rapid. În statul sovietic am asistat la înflorirea strălucitoare a ingineriei electrice. Oamenii de știință ruși au contribuit foarte mult la progrese atât de rapide.
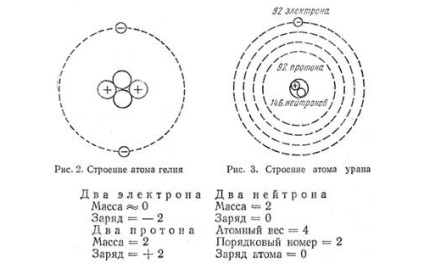
Scheme ale structurii atomului de heliu și uraniu.
Cu toate acestea, este dificil să răspundem simplu la întrebarea: "Ce este electricitatea? “. Putem spune că "electricitatea este încărcături electrice și câmpuri electromagnetice asociate". Dar acest răspuns necesită circum-TION clarificări suplimentare: „Care este sarcinile electrice și câmpurile electromagnetice,“ Treptat, vom arăta cât de dificil este, în esență conceptul de „energie electrică“, deși foarte nefracționar a studiat extrem de diverse electrice YAV-ment, și în paralel cu mai mult înțelegerea lor profundă a extins domeniul aplicării practice a energiei electrice.
Inventatorii primelor mașini electrice au reprezentat curentul electric ca mișcarea unui lichid electric special în fire metalice, dar pentru crearea tuburilor electronice a fost necesară cunoașterea naturii electronice a curentului electric.
Doctrina modernă a electricității este strâns legată de studiul structurii materiei. Cea mai mică particulă a unei substanțe care își păstrează proprietățile chimice este molecula (din cuvântul latin "moles" - mass).
Această particulă este foarte mică, de exemplu, molecula de apă are un diametru de aproximativ 3/1000 000 000 = 3/10 8 = 3 x 10-8 cm și un volum de 29,7 x 10-24.
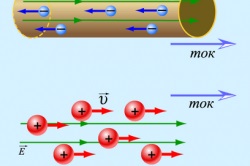
Mișcarea particulelor încărcate într-un conductor.
Pentru a ne imagina mai clar, cât de mici sunt astfel de molecule, ceea ce un număr mare dintre ele este plasat într-un volum mic, putem urmări mental următorul experiment. Observați cumva toate moleculele într-un pahar de apă (50 cm3) și turnați această apă în Marea Neagră. Să ne imaginăm că moleculele conținute în aceste 50 cm3 sunt distribuite uniform pe tot globul oceanului mondial, care ocupă 71% din sfera pământului; Apoi vom scoate din acest ocean, cel puțin în Vla-divostok, din nou un pahar de apă. Este posibil să găsim în acest pahar cel puțin una dintre moleculele etichetate de noi?
Volumul oceanelor lumii este imens. Suprafața sa - 361100000 km 2. Adâncimea sa medie - 3795 urmează secvență m, volumul său -. * 361,1 * 10 iunie W, 795 km 3, adică aproximativ 1370 km LLC = 3 .. 1,37 * 10 9 km 3 - 1,37 * 10 24 cm 3.
Dar în 50 cm 3 de apă conține 1,69 * 10 24 molecule. În consecință, TION, după amestecare, în fiecare centimetru cub de apă ocean va nahoditsya- 1,69 / 1,37 molecule marcate, iar sticla noastra in Vladivostok va primi aproximativ 66 molecule marcate.
Indiferent cât de mici sunt moleculele, ele constau din particule chiar mai mici - atomi.
Atomul este cea mai mică parte a elementului chimic, care este purtătorul proprietăților sale chimice. Un element chimic este de obicei înțeles ca o substanță constând din atomi identici. Molecule pot forma atomi identici (de-exemplu, molecula de H2 gazos de hidrogen este format din doi atomi) sau atomi diferiți (H2 0 molecula de apă constă din doi atomi de hidrogen și un atom de oxigen al H2O). În ultimul caz, atunci când moleculele sunt împărțite în atomi, proprietățile chimice și fizice ale substanței se schimbă. De exemplu, atunci când moleculele de descompunere ale unui corp lichid, apă, se eliberează două gaze - hidrogen și oxigen. Numărul de atomi din molecule este diferită de două (în molecula de apă-un fel) la sute și mii de atomi (în proteine și compuși macromoleculari). Un număr de substanțe, în special metale, nu formează molecule, adică constau în mod direct din atomi care nu sunt legați de legături moleculare.
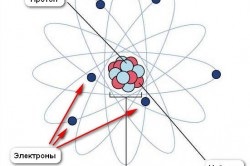
Schema dispozitivului atomului.
Pentru o lungă perioadă de timp, atomul a fost considerat cea mai mică particulă de materie (chiar numele atomului provine din cuvântul grecesc atom-indivizibil). În prezent, se știe că atomul este un sistem complex. Cea mai mare parte a masei atomului este concentrată în centrul său. În jurul nucleului, în anumite orbite, cele mai ușoare particule elementare încărcate electric sunt accesate - electroni la fel cum planetele se învârt în jurul Soarelui. Forțele gravitaționale păstrează planetele în orbitele lor, iar electronii sunt atrași de nucleu de forțele electrice. Acuzațiile electrice pot fi de două tipuri diferite: pozitive și negative. Din experiență știm că numai încărcăturile electrice sunt atrase reciproc. În consecință, încărcăturile nucleului și electronilor trebuie să fie, de asemenea, diferite în semn. Se presupune că încărcarea electronilor este negativă, iar sarcina nucleului este pozitivă.
Toți electronii, indiferent de metoda de producție a lor, au sarcini electrice identice și o masă de 9.108 * 10-28 g. În consecință, electronii care alcătuiesc atomii oricăror elemente pot fi considerați identici.
În același timp, încărcarea electronică (este de obicei indicată cu e) este elementară, adică cea mai mică încărcătură electrică posibilă. Încercările de a dovedi existența unor taxe mai mici nu au reușit.
Apartenența atomului la acest sau la elementul chimic este determinată de mărimea încărcăturii pozitive a nucleului. Încărcarea negativă totală a electronilor unui atom este egală cu sarcina pozitivă a nucleului său, prin urmare, valoarea încărcăturii pozitive a nucleului trebuie să fie eZ. Numărul Z determină măsura elementului din sistemul periodic al elementelor Mendeleyev.
Unii dintre electronii din atom sunt în orbite interne, iar unele în orbite exterioare. Primele sunt relativ ferm în orbitele lor prin legături atomice. Acesta din urmă poate fi relativ ușor separat de atom și să meargă la un alt atom sau să rămână liber de ceva timp. Acești electroni ai orbitelor externe determină proprietățile electrice și chimice ale atomului.
Schema structurii de protoni.
În timp ce suma sarcinilor negative ale electronilor este egală cu sarcina pozitivă a nucleului, atomul sau molecula este neutră. Dar dacă un atom a pierdut unul sau mai mulți electroni, atunci, din cauza excesului sarcinii pozitive a nucleului, devine un ion pozitiv (din cuvântul grecesc ionic). Dacă un atom a capturat excesul de electroni, acesta servește ca un ion negativ. În același mod, ionii pot fi formați din molecule neutre.
Purtătorii încărcăturilor pozitive în nucleul unui atom sunt protoni (din cuvântul grecesc "protos" - primul). Protonul servește drept nucleul hidrogenului - primul element din tabelul periodic. Încărcarea sa pozitivă e + este numeric egală cu sarcina negativă a electronului. Dar masa de protoni este de 1836 ori mai mare decât masa de electroni. Protonii împreună cu neutronii formează nucleul tuturor elementelor chimice. Neutronul (din cuvântul latin "neutru" - nici unul, nici celălalt) nu are o încărcătură, iar masa lui este de 1838 ori mai mare decât masa electronului. Astfel, părțile principale ale atomilor sunt electronii, protonii și neutronii. Dintre aceștia, protonii și neutronii sunt ținuți ferm în nucleul atomului și numai electronii se pot mișca în interiorul substanței, iar încărcăturile pozitive în condiții obișnuite se pot mișca numai împreună cu atomii sub formă de ioni.
Numărul de electroni liberi dintr-o substanță depinde de structura atomilor săi. Dacă există mulți dintre acești electroni, atunci această substanță trece prin încărcături electrice în mișcare prin ea însăși. Se numește dirijor. Toate metalele sunt transportate la conductori. Conductorii deosebit de buni sunt argintul, cuprul și aluminiu. .. Dacă prin orice extern-le conductor de expunere a pierdut unele liber electro-nou, apoi predominanța sarcinilor pozitive ale atomilor săi cu-zdast efect conductor sarcină pozitivă în ansamblu, și anume, conductorul va atrage sarcini negative - libertăți la nivelul electroni și ioni negativi . În caz contrar, cu un exces de electroni liberi, conductorul va fi încărcat negativ.
Un număr de substanțe conțin foarte puțini electroni liberi. Aceste substanțe se numesc dielectrice sau izolatoare. Ei trec prost sau nu trec, practic, încărcături electrice. Dielectricele sunt porțelan, sticlă, abanos, cele mai multe materiale plastice, aer, etc.
În dispozitivele electrice, sarcinile electrice se deplasează de-a lungul conductorilor, iar dielectricii servesc la direcționarea acestei mișcări.
Articole similare
Trimiteți-le prietenilor: