Conceptul de soluții
Soluțiile sunt una dintre soiurile sistemelor de dispersie (din dispersia latină - pentru a dispersa, împrăștia). Toate sistemele dispersate constau dintr-un mediu de dispersie (solvent) și o fază dispersată (o substanță dizolvată). În funcție de ordinea în care starea de agregare și în care gradul de strivire (dispersie) a substanței fac parte din sistemele disperse pot fi împărțite în solide, lichide sau gazoase soluții, aceste soluții coloidale, suspensii, șlamuri, etc.
Clasificarea soluțiilor prin dimensiunea particulelor dizolvate (prin gradul de fragmentare a fazei dispersate)
Prin mărimea particulelor, soluțiile sunt separate în suspensii, soluții coloidale și soluții reale. Pe lângă diferența de dimensiuni ale particulelor, aceste soluții diferă și în ceea ce privește stabilitatea lor în timp.
Astfel, este clar că soluțiile (soluții adevărate) sunt un amestec de solvent și solut, în care materialul tocat la molecule individuale (sau ioni). Dar, dacă suspensiile pot fi ușor diferențiate de soluțiile reale după turbiditate, soluțiile coloidale, la prima vedere, sunt dificil de diferențiat. Cu toate acestea, soluțiile coloidale pot fi ușor determinate printr-un experiment simplu: toate soluțiile coloidale trebuie să prezinte în mod necesar efectul Tyndall. efectul Tyndall este că, atunci când într-o cameră întunecată prin sticlă cu o soluție coloidală de a pierde o rază de lumină de la marginea acestui fascicul este foarte bine vizibilă. efect Tyndall vom vedea destul de des, atunci când ne uităm în fasciculul de lumină care rupe prin perdelele din camera întunecată sau aproape de zăpadă care cade, în lumina farurilor auto sau pe timp de noapte streetlights. soluții adevărate efect Tyndall nu apare, atunci există o rază de lumină a trecut prin sticlă, cu o astfel de soluție nu poate fi văzută din exterior.
Cel mai adesea există soluții în care mediul de dispersie (solvent) al lichidului și, în special, al apei.
În consecință, soluțiile bazate pe solvenți lichizi, în care substanța este măcinată la un nivel molecular, sunt denumite soluții reale.
Soluțiile sunt amestecuri omogene (omogene) dintr-o structură variabilă, constând din mai multe componente și produse ale interacțiunii lor.
Soluție Componenta care este în aceeași stare agregată, iar soluția se numește solvent (sau mediu de dispersie), și alte componente sunt numite soluți (sau fază continuă). Dacă soluția constă dintr-un amestec de două lichide, atunci solventul este numit solvent, care este mai mare. Și dacă unul dintre componente este apă, atunci, indiferent de conținutul său, de obicei în astfel de cazuri solventul se numește apă.
De asemenea, trebuie remarcat faptul că, deși soluțiile sunt numite amestecuri, ele trebuie separate de amestecurile mecanice convenționale. La fel ca amestecurile, soluțiile nu au o compoziție constantă (ca în cazul compușilor chimici) și pot fi împărțite în substanțe individuale (în cazul în care nu apar procese chimice ireversibile). Cu toate acestea, caracteristica principală care caracterizează soluțiile este uniformitatea. În plus, spre deosebire de amestecurile convenționale, soluțiile au interacțiuni inerente între particulele solventului și substanța dizolvată. Pe baza acestui fapt, se poate afirma că soluțiile gazoase sunt amestecuri mecanice de gaze.
Mecanism de dizolvare și efecte termice în timpul dizolvării
Procesul de dizolvare poate fi numit, fără îndoială, atât un proces fizic, cât și un proces chimic. 8 pe de o parte, cu dizolvarea substanței, are loc strivirea acesteia, ceea ce o face asemănătoare cu procesul fizic. Pe de altă parte, în timpul dizolvării, se observă în mod obligatoriu absorbția sau eliberarea căldurii și, în unele cazuri, se formează substanțe noi. Cu toate acestea, procesul de dizolvare nu este atribuit nici unul sau celuilalt. Se numește un proces fizico-chimic. Și acest lucru va deveni mai ușor de înțeles dacă luăm în considerare procesul de dizolvare.
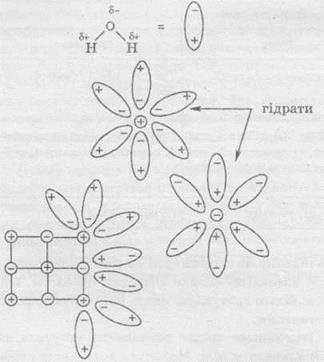
Luați în considerare procesul de dizolvare a cristalului de clorură de sodiu în apă. Molecula de apă este un dipol, care are polii încărcați pozitiv și negativ. Din acest motiv, când cristalul sarei atinge apa, acest cristal este înconjurat de molecule de apă, orientate în mod corespunzător în jurul ionilor încărcați pozitiv și negativ. Și, desigur, moleculele de apă încep să atragă ioni către ei înșiși. Când forța de atragere a ionilor asupra moleculelor de apă devine mai mare decât forța de atracție a cristalului, ionul din mediul înconjurător al moleculelor de apă trece în soluție.
Ioni sau molecule înconjurate de molecule ale solventului se numesc solvați sau, în cazul soluțiilor apoase, hidrați.
În consecință, în procesul de dizolvare, se pot distinge trei etape:
1) interacțiunea particulelor unei substanțe solubile cu molecule de solvenți - solvație (în cazul soluțiilor apoase - hidratare);
2) distrugerea structurii substanței solubile - distrugerea zăcământului cristal - ionizarea;
3) distribuția particulelor solvatate în volumul difuziei solvent-difuziune.
Ca rezultat al primului proces de căldură este eliberată datorită formării de noi legături între particule, și într-o a doua - absorbția căldurii (energia cheltuită pentru distrugerea legăturilor dintre particulele într-o rețea cristalină). În acest sens, efectul termic total al dizolvării este egală cu suma a două efecte menționate procese termice, dacă hidratarea este eliberată mai multă energie decât este consumat în distrugerea rețelei cristaline, energia este eliberată datorită dizolvării și soluția a fost încălzită (exotermic) și invers (endotermic).
dacă (căldura este absorbită);
dacă (căldura este eliberată).
Trimiteți-le prietenilor: