Fig.2. Divizarea d-AO în câmpul terraedric al liganzilor
Suma energiilor AO dg și d # 949; serie conform legii conservării energiei este egală cu valoarea inițială a energiei E0 a orbitalilor degenerați. Diferența dintre energiile noilor subsoluri se numește energia (altfel parametrul) divizării. Valoarea energiei de divizare pentru un agent de complexare dat este determinată de natura ligandului.
Așa-numita serie spectrochimică este stabilită experimental pentru elementele 3d. în care de la stânga la dreapta valoarea numerică # 916; monotonic crește:
I -
<–N CS – (un atom direct asociat cu agentul de complexare este subliniat) Liganzii din partea stângă a seriei (liganzi de câmp slab) determină o descompunere a energiei nesemnificative d # 8209; În acest caz cantitatea # 916; nu depășește energia repulsiei reciproce a electronilor perechi, ceea ce duce la umplerea AO de către electroni în conformitate cu regula Gund (vezi Figura 3).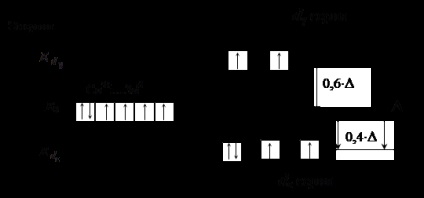
Figura 3. Distribuția de electroni a d-podului în ionul Co 3+ la
aranjament octaedric al liganzilor de câmp slab
Liganzii din partea dreaptă a seriei (liganzi puternici ai câmpului) duc la o diviziune energetică semnificativă a d-podului, # 916; depășește energia repulsiei electron-electron a electronilor perechi. Aceasta înseamnă că este mult mai profitabil să umpleți electronii cu o încălcare a regulii Gund. De exemplu, în cazul aranjamentului octaedric al ligandurilor puternice de câmp, electronii vor umple primul AO la un moment dat, apoi al doilea d # 949; serie, și apoi în aceeași ordine d # 947; (vezi Fig.4). Pentru un câmp tetraedric, ordinul este inversat.
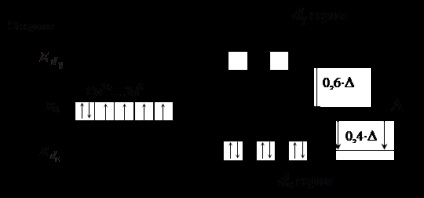
Figura 4. Distribuția de electroni a d-podului în ionul Co 3+ la
aranjament octaedric al liganzilor puternici din câmp
TPL, ca și MFR, face posibilă explicarea proprietăților magnetice ale complecșilor: în prezența electronilor neparticipați, complexul este paramagnetic și, în absența lor, este diamagnetic.
Dacă pe d # 947; subnivel în cazul câmpului ligand octodrului (sau d # 949; subnivel pentru câmpul tetraedrică) este liber (liber) a, ionul complex prin absorbția unei tranziții cuantice de lumină este posibilă din partea inferioară a subnivel energia electronilor la. Astfel de tranziții determină prezența culorii în CS, deoarece energia cuantică a luminii absorbită este egală cu energia de divizare. Pe baza a 1 mol de substanță absorbantă, raportul (J / mol)
,
unde h este constanta Planck (h = 6,63 × 10 -34 J x s); c este viteza luminii (c = 3 × 10 8 m / s); NA - constanta Avogadro (NA = 6, 02 x 10 23 mol -1); l - lungimea de undă a luminii absorbite, m.
Când o lumină cu o lungime de undă a unei anumite părți a spectrului este absorbită, substanța se dovedește a fi colorată în culoarea corespunzătoare. Când un ligand este înlocuit în complex de alții având o intensitate mai mare a câmpului, valoarea # 916; crește, iar complexul începe să absoarbă raze de lumină cu o lungime de undă mai mică. Aceasta își schimbă culoarea. De exemplu, complexele de cupru (II), la trecerea de la [CuCl4] 2+ la [Cu (H2O) 4] 4+ și [Cu (NH3) 4] 2+ schimbat culoarea de la albastru, prin verde la albastru-violet.
Atunci când se caracterizează stabilitatea complexelor, se folosesc concepte precum stabilitatea și inerția sau instabilitatea și labilitatea. Stabilitatea complexului este caracteristică termodinamică a acestuia și este asociată cu energiile legăturilor formate și cu schimbarea entropiei în timpul complexării. Inerția și, invers, labilitatea complexului sunt caracteristicile sale cinetice, care depind de ratele de substituție a liganzilor săi. Sistemele stabile pot fi inerte și instabile. De exemplu, ionii [Cr (H2O) 6] 3+ și [Fe (H2O) 6] 3+ au energii de legare apropiate, adică au aproape aceeași stabilitate, dar primul complex este inert și schimbă încet liganzii, iar al doilea este labil, deoarece schimbă rapid liganzi. Complexele instabile sunt cel mai adesea instabile.
Când este dizolvat în apă, KS, având o sferă exterioară, disociază ca electroliți puternici formarea unui ion complex constând din particule ale sferei interioare și ioni ai sferei exterioare. Acest proces se numește disociere primară. De exemplu
Împreună cu acest proces, de regulă, există o disociere reversibilă a sferei interioare, care se numește disociere secundară. Pentru ionul [Fe (CN) 6] 4, acest procedeu se desfășoară conform următoarelor etape
prima etapă [Fe (CN) 6] 4-CN- [Fe (CN) 5] 3-
a doua etapă este [Fe (CN) 5] 3 - ↔ CN - + [Fe (CN) 4] 2-, etc.
Caracteristica cantitativă a rezistenței unui ion complex este constanta de echilibru a procesului de disociere secundară, numită constanta de instabilitate a lui Knest. De exemplu, pentru ionul [Fe (CN) 6], constantele de instabilitate 4 ale primei și celei de-a doua etape sunt exprimate prin ecuațiile
;
În practică, valoarea constantei generale a instabilității Knest este mai des utilizată. care caracterizează echilibrul total al disocierei secundare. De exemplu, pentru ionul [Fe (CN) 6] 4-
[Fe (CN) 6] 4 - ↔ 6CN - + Fe 2+.
Knestul este egal cu produsul constantelor de instabilitate ale tuturor etapelor:
Uneori, în loc de Knest, ei folosesc valoarea reciprocă - stabilitatea și stabilitatea tufișului
Dacă complexele au același număr de liganzi, atunci stabilitatea lor poate fi determinată din constanta generală de instabilitate: cu atât mai mică este Knest. cu cât ionul complex este mai stabil.
Compararea complecșilor Knest pentru reactiv și pentru produs (la KC constant) face posibilă stabilirea direcției deplasării echilibrului reacției de schimb de ligand în soluție. De exemplu, pentru un proces
comparând Câmpul de ioni [PtCl4] 2- și [PtI4] 2-. care sunt de 1 × 10-16 și, respectiv, 1 × 10-31, se poate observa că produsul complex de ioni este mult mai stabil decât complexul de reactiv. În consecință, echilibrul unui astfel de proces este puternic deplasat spre dreapta, adică această reacție se desfășoară în direcția înainte.
Exemple de rezolvare a problemelor
Exemplul 1. Se determină încărcarea agentului de complexare în compusul [Co (NH3) 4Cl2] NO2. Denumiți această conexiune.
Sfera exterioară a CS constă într-un anion NO. prin urmare, sarcina întregii sfere interioare este +1, adică [Co (NH3) 4Cl2] +. Sfera interioară conține două grupe de liganzi NH3 și Cl -. Gradul de oxidare a agentului de complexare este notat cu x și rezolvăm ecuația
+1 = 1 × x + 0 · 4 + 2 · (-1). Prin urmare, x = +1.
Astfel, CS este un cation complex. Denumirea compusului: nitrat de cobalt diclorotetraamină amoniu (+1).
Exemplul 2. De ce are ionul [Cu (NH3) 2] + o structură liniară?
Se determină încărcarea agentului de complexare în acest ion complex
+1 = 1 × x + 0,2. Prin urmare, x = +1.
Structura electronică a valenței ionilor subnivele Cu + 10 corespunde configurației 3d 4s 4p 0 0. Deoarece 3d - subnivel nu conține posturi vacante în formarea de legături ale mecanismului donor-acceptor (ca scavenger) de către Cu + angajeze un 4s și 4p orbitali unul , care hibridizează ca sp. Acest tip de hibridizare (vezi Tabelul 1) corespunde structurii liniare a complexului.
Exemplul 3. Se determină tipul de hibridizare a ionului central AO și structura geometrică a complexului [HgCl4] 2-.
Configurația electronică a ionului central Hg 2+. 5d 10 6s 0 6p 0. Schema electronică poate fi reprezentată după cum urmează
Cinci electroni 3d sunt complet distribuiți pe orbital 3d # 949; , deoarece energia de divizare, care apare atunci când interacționează cu liganzi puternici de câmp, se dovedește a fi suficientă pentru o pereche maximă de electroni. Gratuit 3d. 4s și 4p orbitale suferă hibridizare d2sp3 și provoacă structura octaedrică a complexului. Complexul este un paramagnet; există un electron neparat

Exemplul 5. Compuneți diagrama energetică a formării legăturilor în complexul [CrF4] - și indicați tipul de hibridizare.
Formula electronică este Cr 3+. ... 3d 3 4s 0 4p 0 4d 0. Liganzii monodentați ai lui F formează patru Conexiunile sunt liganzi de câmp slab și creează un câmp tetraedric
Gratuit două 3d. un 4s și un 4p din complexul agent de complexare hibridizează ca d2 sp. Ca rezultat, se formează un complex paramagnetic al configurației tetraedrice.
Exemplul 6. Explicați de ce ionul [CoF6] este 3-paramagnetic, iar [Co (CN) 6] ionul este 3-diamagnetic.
Formula electronică a agentului de complexare Co 3+. ... 3d 6. octaedrice câmp ligand F - (câmpul ligand slab) apare o ușoară separare subnivel d-, astfel încât electronii umple AO în conformitate cu articolul Gunda (vezi Fig.3.). În acest caz, există patru electroni nepartiți, deci ionul [CoF6] este 3-paramagnetic. În formarea ionului [Co (CN) 6] 3- implicând liganzi de câmp puternic (ion CN -) subnivele energie d- divizare va fi atât de mare încât depășește energia electronilor pereche de repulsie electron-electron. Electronii vor umple spațiul comun al ionului Co 3+ în încălcarea regulii Gund (vezi figura 4). În acest caz, toți electronii sunt împerecheați, ionul în sine este diamagnetic.
Exemplul 7. Pentru ionul [Cr (H20) 6] 3+, energia de divizare este de 167,2 kJ.mol -1. Care este culoarea compușilor de crom (III) în soluții apoase?
Pentru a determina culoarea materiei, determinăm lungimea de undă la care este absorbit lumina
Astfel, ionul [Cr (H20) 6] 3+ absoarbe lumina în partea roșie a spectrului, care corespunde culorii compusului de crom (III) de culoare verde.
Exemplul 8. Stabilirea dacă sulfura de argint precipitat cade (I), la o temperatură de 25 ° C, dacă se amestecă volume egale de soluție de 0,001 M [Ag (CN) 2] -, ligandul CN- având același nume cu o concentrație de 0,12 mol / dm 3, și soluție de precipitant ionizant S2- cu o concentrație de 3,5.10-3 M.
Procesul de disociere pentru un ion dat poate fi reprezentat de o schemă
iar procesul de depunere poate fi scris după cum urmează
2Ag + + S 2 - ↔ Ag2S¯.
Pentru a determina dacă se va forma un precipitat, este necesar să se calculeze produsul de solubilitate a sulfurii de argint OL (Ag2S) prin formula
Pentru a determina concentrația ionilor de argint, scriem expresia pentru constanta de instabilitate a unui ion complex
Din manual, alegem valoarea constantei de instabilitate a complexului [Ag (CN) 2] - (Knest = 1 · 10-21). atunci
Se calculează produsul de solubilitate a precipitatului format
.
Conform ghidului, alegem valoarea tabelară a produsului de solubilitate al sulfurii de argint (tabelul OL (Ag2S) = 5.7 · 10 -51) și o comparați cu valoarea calculată. De la PRB <ПРрасчет. то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
Exemplul 9. Se calculează concentrația de ioni de zinc într-o soluție de tetracicanoat de sodiu la o concentrație de 0,3 mol / dm3 cu un exces de ioni de cianură într-o soluție egală cu 0,01 mol / dm3.
Disocierea primară se realizează aproape în întregime conform schemei
Disocierea secundară se realizează prin ecuație
Pentru acest proces se scrie expresia pentru constanta de instabilitate
Conform manualului, găsim valoarea constantei de instabilitate a unui ion dat (Knest = 1,3 · 10 -17). Concentrația ionilor de cianură formată ca urmare a disocierii complexului este mult mai scăzută decât concentrația excesului introdus și se poate presupune că [CN -] 0,01 moli / dm 3, adică concentrația ionilor CN. Disocierea rezultată poate fi neglijată. atunci
Energetica proceselor chimice. 3
Scurt informații teoretice. 3
Exemple de rezolvare a problemelor. 10
Chinetica chimică și echilibrul. 17
Scurt informații teoretice. 17
Exemple de rezolvare a problemelor. 22
Conexiuni complexe. 28
Scurt informații teoretice. 28
Exemple de rezolvare a problemelor. 39
Articole similare
Trimiteți-le prietenilor: