Efectul presiunii asupra solubilității substanțelor solide și lichide nu are practic niciun efect, deoarece Volumul sistemului se modifică nesemnificativ. Numai la presiuni foarte mari modificarea solubilității devine vizibilă. Astfel, de exemplu, solubilitatea NH4NO3 este aproape înjumătățită când presiunea este ridicată la 10 6 kPa (adică aproximativ 10 000 de ori mai mare decât presiunea atmosferică).
Presiunea are un efect semnificativ numai asupra solubilității gazelor. Și dacă nu există nicio interacțiune chimică între gaz și solvent, în conformitate cu legea lui Henry, solubilitatea gazului la o temperatură constantă este direct proporțională cu presiunea asupra soluției
unde k este coeficientul de proporționalitate, care depinde de natura lichidului și gazului și p este presiunea gazului deasupra soluției.
Legea lui Henry este valabilă numai pentru soluțiile diluate și în condiții de presiuni reduse.
În cazul în care nu se dizolvă o singură substanță gazoasă și un amestec de mai multe gaze, soglasnozakona Daltonarastvorimost fiecare component al amestecului la o temperatură constantă este proporțională cu presiunea parțială deasupra lichidului și este independent de presiunea totală a amestecului și prezența altor gaze.
Presiunea parțială a unui gaz individual în amestec (p1) se calculează prin formula:
unde este presiunea totală a amestecului de gaz; X1 este fracția molară a gazului din amestec.
Dacă amestecul gazos constă din mai multe componente, presiunea sa totală este determinată de suma presiunilor parțiale ale tuturor gazelor care intră în amestec:
Gazele care interacționează cu un solvent (de exemplu, NH3, S02, HCI) nu respectă legea lui Henry și Dalton atunci când sunt dizolvate în H2O. Solubilitatea lor crește, de asemenea, odată cu creșterea presiunii, dar într-o relație mai complexă.
Scăderea presiunii gazului de deasupra soluției duce la o scădere a solubilității sale și eliberarea de lichid sub formă de bule.
Prin varierea solubilitatea gazului cu o scădere bruscă a presiunii din cauza așa-numitele coturile, care se pot dezvolta scafandri care lucrează în apă adâncă. În aceste condiții, respiră sub presiune ridicată. În acest caz, solubilitatea gazelor din sânge crește foarte mult. Dacă după terminarea lucrului se ridică prea repede suprafața, atunci datorită unei scăderi drastice a presiunii, excesul de gaze dizolvate în sânge începe să iasă viguros. Bulele formate infunda vasele de sânge, ceea ce duce la întreruperea fluxului sanguin, sângerare în numeroase țesuturi și organe din cauza ruperii capilarelor diferite.
Prin urmare, ridicarea la suprafață din adâncimi mari ar trebui să fie suficient de lungă și lentă, astfel încât excesul de gaz să poată fi scos din sistemul circulator prin sistemul respirator.
O imagine similară poate apărea atunci când depresurizarea la cabinele de înaltă altitudine și saloanele de aeronave, costumele de piloți militari.
Efectul temperaturii asupra solubilității substanțelor
Solubilitatea celor mai multe substanțe solide și lichide crește odată cu creșterea temperaturii. Pentru unele substanțe solide (mai ales dacă se disipează căldura în timpul dizolvării), solubilitatea, dimpotrivă, poate scădea odată cu creșterea temperaturii.
Dependența solubilității substanțelor la temperatură este adesea prezentată grafic folosind grafice, care sunt denumite curbe de solubilitate (Figura 20).
Solubilitatea gazelor scade odată cu creșterea temperaturii. Cu fierbere prelungită, este posibilă îndepărtarea aproape completă a gazelor dizolvate din lichid. Saturarea aceluiași gaz lichid, dimpotrivă, este mai adecvată pentru efectuarea la temperaturi scăzute.
Modificarea solubilității cu temperatura este adesea utilizată pentru purificarea substanțelor prin recristalizare. La răcire, o soluție caldă saturată de sare contaminate cu materii străine, o mare parte a acestora (săruri) este izolat sub formă de precipitat și impuritățile rămân în soluție, deoarece acesta din urmă chiar și în frig împotriva lor nu vor fi saturate.
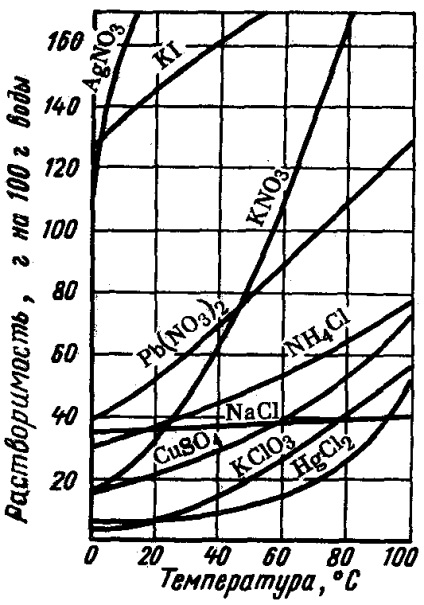
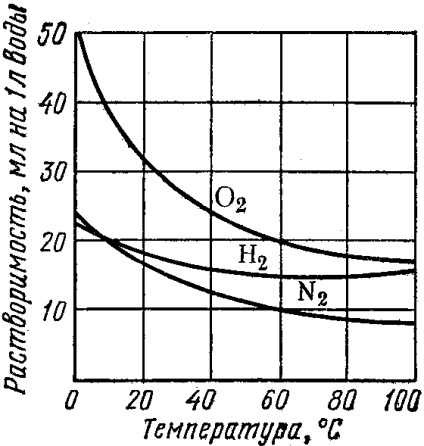
Fig. 20. Curbele de solubilitate ale substanțelor solide (1) și ale gazelor (2) în funcție de temperatură
În mod similar, este posibilă purificarea numai a acelor solide a căror solubilitate este dependentă în mare măsură de temperatură.
Articole similare
Trimiteți-le prietenilor: