Ideea unui biofilm al cavității orale
Studiile ne-au schimbat radical înțelegerea bolilor parodontale și a efectului lor asupra organismului. Timp de decenii, informatii despre boala parodontală a rămas practic neschimbat, dar realizările științifice din ultimii 10 ani au arătat o legătură cu ansamblu sănătatea orală, care periodontita este cheia pentru o serie de boli sistemice, deoarece acestea provoacă sau complică cursul lor.
Multe condiții ale corpului sunt asociate cu biofilmul cavității orale: boli cardiovasculare, diabet, boli pulmonare, rinichi și osteoporoză. Relația dintre boala de prostata este de asemenea dovedit, cancerul de colon si cancer pancreatic, rezolvarea problemei sarcinii (inclusiv nastere prematura si greutatea mica la nastere) cu biofilmul oral care cauzeaza boala parodontală. Dar ce este biofilmul cavității orale?
Biofilm al cavității bucale: Ce este?
Am numit-o o placă, o acoperire moale, lipicioasă, care conține particule de hrană și bacterii care se formează continuu pe suprafața dinților și a gingiilor. Dar acum este deja clar că această placă este mult mai complicată decât se credea anterior. Cea mai bună definiție a biofilmului este o structură specifică, dar foarte variabilă, formată din microorganisme și produse ale activității lor vitale, încorporată într-o matrice intercelulară foarte organizată. Biofilmul constă în diverse microorganisme implicate într-o gamă largă de interacțiuni fizice, metabolice și moleculare. Natura cooperativă a comunității microbiene în biofilme oferă avantajul creșterii pentru bacterii, o rezistență mai mare la apararea gazdei și la agenții antimicrobieni, ceea ce sporește și patogenitatea comunității microbiene.
Pentru a înțelege cum să facem față biofilmelor, trebuie să înțelegem ce este. Costerton introdus pentru prima dată termenul în 1978, pentru a sublinia faptul că bacteriile sunt combinate intr-un „film de viu“, care interacționează cu okruzheniem.Bioplenka sa format pe aproape orice suprafață într-un mediu umed natural. Bacteriile bacteriene au proprietăți noi care nu sunt caracteristice bacteriilor în starea planctonică. Fiziologic, bacteriile biofilm diferă de celulele planctonice care se mișcă liber în fluidele corporale: saliva sau sângele. Formarea unui biofilm este un proces complex care trece prin câteva faze diferite (Figura 1).

Figura 1. Fazele de viață a biofilmului: atașament, creștere și detașare
Procesul începe cu adsorbția unui film adeziv de bacterii și molecule gazdă pe suprafața dinților. Aceasta este urmată de transportul pasiv de bacterii, mediatizat de forțele de atracție slabe pe distanțe lungi. Aceste forțe sunt covalent legături de hidrogen, cu toate acestea conduc la atașarea ireversibilă a microorganismelor la poverhnosti.Dalee biofilm autoagregare formate de bacterii și o specie de koagregatsii între tipuri diferite de bacterii care duce la organizarea funcțională a tuturor structurii microorganismelor. Microclimatul se schimbă de la aerobic la facultativ-anaerob cu bacteriile corespunzătoare care secretă matricea extracelulară a biofilmelor.
În viitor, procesul de maturare a biofilmului implică introducerea de noi tipuri de bacterii și formarea unei comunități complexe. După maturare, părți din biofilm sunt deconectate și împrăștiate în alte părți ale cavității orale, formând un nou biofilm sau influențând corpul. Biofilmele se formează pe o perioadă de 2-3 zile. Aceasta înseamnă că, cu condiția igienei profesionale și a curățeniei la domiciliu, recuperarea este destul de rapidă. În plus, biofilmul poate diferi în compoziție în diferite locuri de formare, chiar dacă acesta este buzunare adiacente, ceea ce complică eliminarea acestuia (Figura 2).

Suprafața care acoperă biofilmul asigură o protecție maximă a bacteriilor din mecanismele antibacteriene ale gazdei și al altor agenți "toxici", cum ar fi antibioticele și antisepticele. Sensibilitatea generală observată în bacteriile din biofilme crește, de asemenea, rezistența la influențele externe. Prin sensibilitatea generală, reglarea genetică a rezistenței la antibiotice poate oferi protecție pentru biofilmele bacteriene. În plus, comunitatea bacteriană poate influența compoziția speciei sale, susținând creșterea microorganismelor necesare, împiedicând creșterea competitorilor.
Cum pot gestiona biofilmul?
Curățarea mecanică a buzelor parodontale îndepărtează doar 50% din biofilmul prezent. Dar creșterea sa repetată are loc în trei ore, cu o creștere de 4 ori (400%) a greutății biofilmului. Și deoarece conținutul buzunarului nu este disponibil pentru igienă cu o perie și fir, efectul igienei la domiciliu este nesigur, indiferent de gradul de diligență al pacientului. Perii periuței de dinți nu pot penetra mai mult de 3 mm în buzunarul gingival și nu pot afecta mecanic biofilmul situat mai adânc. Probleme similare apar cu irigatoarele. Irigarea fundului buzunarului pe toate dinții este dificilă din punct de vedere tehnic, iar majoritatea pacienților nu o aplică zilnic. Chiar dacă biofilmul este îndepărtat mecanic, bacteriile se înmulțesc atât de repede încât nu pot fi controlate. Structura biofilmului după îndepărtarea acestuia este restabilită în două zile și devine și mai complicată.
Medicii trebuie să coopereze cu pacienții și să utilizeze o tehnică convenabilă pentru a le folosi, dar sunt eficienți împotriva biofilmului, ajungând la fundul buzunarelor și împiedicând astfel re-creșterea acestuia. Antibioticele sunt extrem de limitate pentru această sarcină. Bacteriile bacteriene sunt de 1000 de ori mai rezistente la antibiotice decât forma planctonică. Utilizarea sistemică a antibioticelor, sub formă de clătiri sau aplicații, nu este în măsură să elimine sau să controleze în mod adecvat bacteriile din biofilm. Acest lucru este important atât pentru dinții naturali cât și pentru problemele parodontale din jurul implanturilor care conduc la peri-implantitis.
Se știe că clorhexidina afectează un biofilm tânăr, dar bacteriile unui film matur sunt mai rezistente la efectele sale. Peroxidul de hidrogen, dimpotrivă, este eficient în mod fiabil nu numai în eliminarea biofilmelor, dar previne și reformarea acestuia fără formarea rezistenței, caracteristică altor metode de tratament. Utilizarea peroxidului de hidrogen a fost studiată zilnic până la 6 ani fără efecte secundare sau activitate carcinogenă, scăderea semnificativă a biofilmului și ameliorarea vindecării rănilor, scăderea hemoragiei gingivale. Mai mult, nu a înregistrat reacții alergice și formarea rezistenței bacteriilor. Peroxidul distruge matricea de mucus a biofilmelor și a pereților celulelor bacteriene, în esență "exfolierea" stratului de film pe strat. Acest lucru se datorează distrugerii ireversibile a lanțurilor de proteine la aminoacizi.
Peroxidul distruge pelicula proteică care atașează biofilmul pe suprafața dinților și reduce inflamația în buzunar prin inhibarea ARNm interleukinei-8. Oxigenul este necesar pentru o vindecare reușită a rănilor, deoarece crește necesitatea proceselor reparative: proliferarea celulelor, angiogeneza, sinteza de colagen - peroxidul furnizează oxigen pentru procesele de reparare. În plus, oxigenul necesită creșterea celulelor noi, inclusiv. nave noi. Ei, de asemenea, aduc sânge îmbogățit cu oxigen la rană, începând cu vindecarea. Ca urmare, un nou țesut de granulare îmbogățit cu oxigen este vascularizat mai bine. Aceasta duce la formarea de fibre de colagen mai elastice.
Distrugerea biofilmului de către peroxidul de hidrogen
Studiile științifice multiple publică date privind concentrația ideală de peroxid de hidrogen de 1,7%, deoarece distrug biofilmul și aproape nu provoacă iritarea țesutului, caracteristică concentrațiilor mai mari. Problema este furnizarea de peroxid la partea inferioară a buzunarului parodontal și expunerea acestuia pe durata expunerii la biofilme. Din punct de vedere fiziologic, lichidul din buzunar este secretat în mod constant pentru eliminarea bacteriilor. Din păcate, spală toate drogurile folosite pentru a iriga buzunarul. În mod normal, lichidul cervical este înlocuit de 40 de ori pe oră. În țesutul inflamat, producția de lichid gingival poate fi mărită de 30 de ori. Acest lucru duce la o spălare extrem de rapidă a oricărui preparat utilizat local din buzunarul gingival. Și din moment ce gelul peroxid de hidrogen are nevoie de ceva timp pentru a intra în contact, introducerea acestuia în buzunar cu o seringă de irigație nu este eficientă datorită curentului fluidului gingival și este prea consumatoare de timp pentru pacient.
Sa determinat că o expunere de 10 minute a 1,7% din gelul peroxid de hidrogen conduce la penetrarea mucusului matricei și la distrugerea peretelui celular al bacteriilor cu biofilm. Fiind în buzunarul parodontal, peroxidul eliberează oxigen, schimbând microclimatul subgingival, ceea ce face ca supraviețuirea bacteriilor anaerobe să fie dificilă. Pe măsură ce habitatele microorganismelor se modifică, matricea care leagă biofilmul se prăbușește, apoi bacteriile cu adâncime se află sub influența oxigenului. Pentru a vindeca boala parodontală, peroxidul trebuie să pătrundă în fundul buzunarului și să fie acolo pentru o perioadă suficientă de timp pentru a acționa asupra biofilmului. Studiile au arătat că soluțiile de spălare și alte produse de igienă cu peroxid nu pot fi eficiente în furnizarea substanței adânc în buzunarul parodontal pentru a influența infecția.
Pentru a obține o penetrare maximă a peroxidului în buzunar și pentru a mări nivelul de respectare a pacienților, pot fi fabricate gură de protecție individuală, cum ar fi PerioTray®, PerioProtect®. Când purtați kappa cu hidrogen peroxid de gel timp de 15 minute. medicamentul pătrunde în fundul buzunarului> 7 mm (fig.3-5).
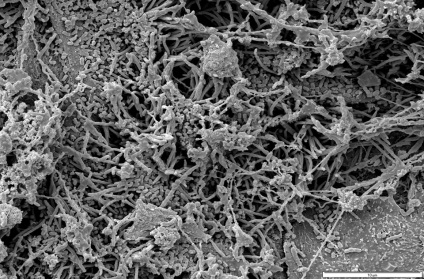
Figura 3. Biofilm înainte de aplicarea peroxidului de hidrogen 1,7%
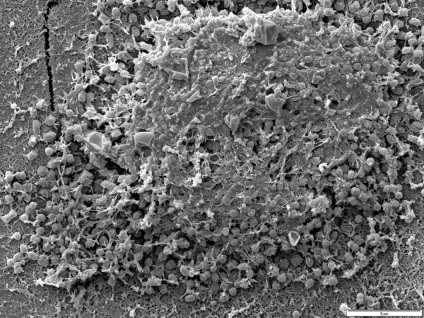

Skyling și netezirea rădăcinii sunt încă o parte integrantă a terapiei parodontale și ajută la distrugerea biofilmelor în sulcusul gingival. Tratamentul suplimentar cu un gel de 1,7% peroxid de hidrogen într-un kappa nu înlocuiește în niciun fel tratamentul mecanic al rădăcinilor și al buzelor. Kappas îmbunătățește tratamentul profesional și îi ajută pe pacient să mențină igiena în zone inaccesibile periei și firului dentar. Utilizarea peroxidului de hidrogen în kappa poate fi considerată ca o metodă eficientă de terapie de întreținere, ușoară și convenabilă pentru pacient, necesitând un timp minim de efectuat.
Trimiteți-le prietenilor: