Informații generale privind structura atomului de potasiu
Potasiul este primul element al celei de-a patra perioade. Este situat în grupa I a principalului (A) subgrup al mesei periodice.
Se referă la elementele familiei s. Metal. Elementele metalice, care fac parte din acest grup, se numesc alcaline. Denumire - K. Numărul secvenței - 19. Masa atomică relativă - 39.102 amu.
Structura electronică a atomului de potasiu
Atomul de potasiu constă dintr-un nucleu încărcat pozitiv (+19), în interiorul căruia sunt 19 protoni și 20 de neutroni, iar circa 19 electroni se mișcă în jurul celor 4 orbite.
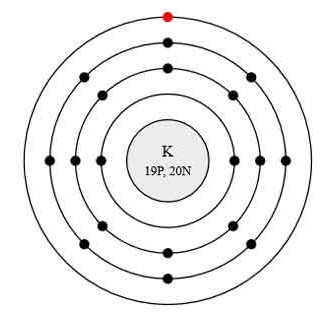
Fig.1. Structura schematică a atomului de potasiu.
Distribuția electronilor de-a lungul orbitalilor este după cum urmează:
Nivelul energetic extern al atomului de potasiu conține un electron, care este valența. Gradul de oxidare a potasiului este +1. Diagrama energetică a stării de bază are următoarea formă:
Starea excitat, în ciuda prezenței de 3p și 3-orbitale vacante, nu este prezentă.
Exemple de rezolvare a problemelor
Atomul elementului are următoarea configurație electronică: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3. Specificați: a) încărcătura nucleară; b) numărul de nivele de energie completate în coaja de electroni a acestui atom; c) gradul maxim de oxidare posibil; d) valența atomului din compus cu hidrogen.
Pentru a răspunde la întrebările puse, este necesar mai întâi să determinăm numărul total de electroni din atomul unui element chimic. Acest lucru se poate face prin combinarea tuturor electronilor din atom, fără a ține seama de distribuția lor pe nivelurile de energie:
Acesta este arsen (As). Acum răspunde la întrebări:
a) sarcina nucleului este +33;
b) atomul are patru nivele, dintre care trei sunt completate;
c) Scrieți diagrama energetică a electronilor valenți ai atomului de arsen în starea solului.
Arsenicul este capabil să treacă într-o stare excitată: electronii s-subveliș sunt vaporizați și unul dintre ei trece la orbita d-gol.
Cinci electroni neparticipați indică faptul că gradul maxim posibil de oxidare a arsenicului este +5;
d) Valence de arsen în combinație cu hidrogen este egal cu III (AsH3).
Articole similare
Trimiteți-le prietenilor: