În cazul în care un pahar deschis de apă este lăsat pentru o lungă perioadă de timp, atunci în cele din urmă apa se va evapora complet. Se va evapora mai precis. Ce este evaporarea și de ce apare?
2.7.1 Evaporarea și condensarea
La o anumită temperatură, moleculele lichidului au viteze diferite. Vitezele majorității moleculelor sunt apropiate de o valoare medie (caracteristică acestei temperaturi). Dar moleculele se întâlnesc, vitezele cărora diferă semnificativ de media în ambele părți mai mici și cele mai mari.
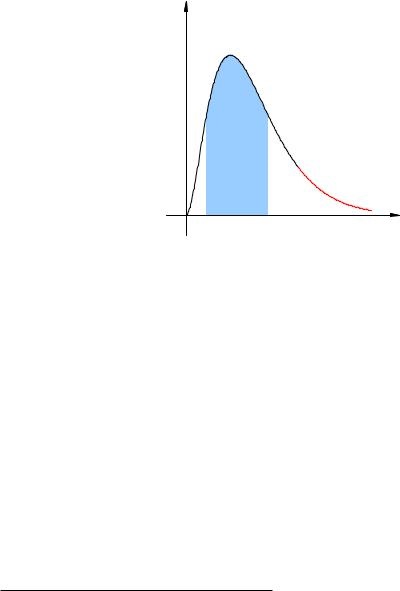
În Fig. 2.16 prezintă un grafic aproximativ al distribuției moleculelor de fluid asupra vitezelor. Fundalul albastru arată că majoritatea moleculelor ale căror viteze sunt grupate în jurul valorii medii. Cozile roșii ¾ din grafic reprezintă un număr mic de molecule rapide 2 ale căror viteze depășesc substanțial viteza medie a masei moleculelor lichide.
Fig. 2.16. Distribuția vitezei moleculelor
Atunci când o astfel de moleculă ar fi destul de rapid pe suprafața liberă a lichidului (m. E. La interfața de lichid și aer în această secțiune), energia cinetică a moleculei poate fi suficientă pentru a se asigura că depășirea forțele de atracție și alte molecule pentru a acoperi din lichid. Acest proces este evaporarea și moleculele care părăsesc forma lichidă.
Astfel, evaporarea este procesul de transformare a unui lichid în vapori, care are loc pe suprafața liberă a unui lichid.
Se poate întâmpla ca după o perioadă molecula de vapori să se întoarcă înapoi în lichid.
Procesul de tranziție a moleculelor de vapori într-un lichid se numește condensare. Procedeul de condensare prin aburi, inversează evaporarea lichidului.
2.7.2 Echilibrul dinamic
Și ce se va întâmpla dacă un recipient cu un lichid este etanșat bine? Densitatea vaporilor deasupra suprafeței lichidului începe să crească; particulele de vapori vor interfera din ce în ce mai mult cu alte molecule ale lichidului pentru a zbura în afară, iar viteza de evaporare va începe să scadă. În același timp, va începe
7 În condiții speciale, transformarea lichidului în vapori poate să apară pe tot parcursul volumului lichidului. Acest proces este bine cunoscut pentru această fierbere.
crește gradul de condensare, deoarece, odată cu creșterea concentrației de vapori, numărul de molecule care se întorc la lichid va deveni din ce în ce mai mare.
În cele din urmă, la un moment dat, rata de condensare va fi egală cu rata de evaporare. Va exista un echilibru dinamic între lichid și vapori: pentru o unitate de timp, cât mai multe molecule vor lăsa lichidul când acesta se va întoarce la el din vapori. Din acest punct, cantitatea de lichid va înceta să scadă, iar cantitatea de abur va crește; Vaporii vor ajunge la saturație.
Aburul saturat este un abur care se află într-o stare de echilibru dinamic cu lichidul său. Aburul care nu atinge starea echilibrului dinamic cu un lichid se numește nesaturat.
Presiunea și densitatea vaporilor saturați sunt notați cu p și n. Evident, p n și n sunt presiunea maximă și densitatea pe care aburul o poate avea la o anumită temperatură. Cu alte cuvinte, presiunea și densitatea vaporilor saturați depășesc întotdeauna presiunea și densitatea vaporilor nesaturați.
2.7.3 Proprietăți saturate ale aburului
Se pare că starea de vapori saturați (ca mai multe legături nesaturate) poate fi descrisă aproximativ prin ecuația de stare de gaz ideal (ecuația Mendeleev-Clapeyron). În special, avem o relație aproximativă între presiunea saturată a vaporilor și densitatea sa:
Acesta este un fapt foarte surprinzător, confirmat de experiment. La urma urmei, din punctul de vedere al proprietăților sale, vaporii saturați diferă semnificativ de un gaz ideal. Permiteți să enumerăm cele mai importante dintre aceste diferențe.
1. La o temperatură constantă, densitatea vaporilor saturați nu depinde de volumul său.
Dacă, de exemplu, abur saturat comprima izoterm, apoi densitatea la prima creștere, rata de condensare depășește viteza de evaporare și a vaporilor este condensat în lichid înainte de a până din nou să nu apară echilibru dinamic, în care densitatea vaporilor revine la valoarea anterioară.
In mod similar, în expansiune izotermă saturate cu abur densitatea la primele scăderi (vaporii devine nesaturat), viteza de evaporare depășește viteza de condensare și lichidul se evaporă în continuare până încă o dată care nu este stabilit dinamic echilibru m. E. Până când aburul din nou devine saturat cu aceeași valoare a densității.
2. Presiunea vaporilor saturați nu depinde de volumul lor.
Aceasta rezultă din faptul că densitatea vaporilor saturați este independentă de volum, iar presiunea este legată în mod unic de densitate de ecuația (2.6).
După cum vedem, legea lui Boyle Marriott, valabilă pentru gazele ideale, nu ține de vapori saturați. Acest lucru nu este surprinzător, deoarece a fost obținut din ecuația lui Mendeleev de Clapeyron, presupunând că masa gazului rămâne constantă.
3. Cu un volum nemodificat, densitatea vaporilor saturați crește odată cu creșterea temperaturii și scade odată cu scăderea temperaturii.
Într-adevăr, pe măsură ce crește temperatura, viteza de evaporare a lichidului crește. Dinamismul dinamic este încălcat în primul moment, iar unul suplimentar
evaporarea unei părți din lichid. Perechea va fi adăugată până când echilibrul dinamic va fi restabilit din nou.
În mod similar, atunci când temperatura este scăzută, viteza de evaporare a lichidului devine mai mică și o parte din vapori se condensează până când echilibrul dinamic este restabilit cu o cantitate mai mică de abur.
Astfel, cu încălzirea sau răcirea izochorică a vaporilor saturați, masa sa se schimbă, astfel încât legea lui Charles nu funcționează în acest caz. Dependența presiunii vaporilor saturate de temperatura nu mai este o funcție liniară.
4. Presiunea saturată de vapori crește cu temperatura mai rapidă decât liniar.
De fapt, pe măsură ce crește temperatura, densitatea saturată de vapori crește și conform ecuației (2.6), presiunea este proporțională cu produsul densității prin temperatură.
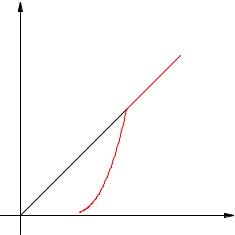
Dependența presiunii de vapori saturate asupra temperaturii este exponențială (Figura 2.17). Este reprezentat prin figura 1-2 a programului. Această dependență nu poate fi derivată din legile unui gaz ideal.
Fig. 2.17. Dependența presiunii de vapori la temperatură
La punctul 2, se evaporă tot lichidul; cu o creștere suplimentară a temperaturii, vaporii devin nesaturați și presiunea lor crește liniar conform legii lui Charles (secțiunea 2-3).
Să ne amintim că creșterea liniară a presiunii unui gaz ideal este cauzată de creșterea intensității impactului moleculelor pe peretele vasului. Dacă vaporii saturați sunt încălziți, moleculele încep să bată nu numai mai mult, dar mai des, perechea devine mai mare. Acțiunea simultană a acestor doi factori determină creșterea exponențială a presiunii saturate a vaporilor.
2.7.4 Umiditatea aerului
Aerul care conține vapori de apă se numește umed. Cu cat mai mult abur este in aer, cu atat umiditatea aerului este mai mare.
Umiditatea absolută este presiunea parțială a vaporilor de apă din aer (adică presiunea pe care vaporii de apă ar avea-o singură, în absența altor gaze). Uneori, umiditatea absolută se mai numește densitatea de vapori de apă în aer.
Umiditatea relativă a aerului este raportul dintre presiunea parțială a vaporilor de apă din aceasta și presiunea vaporilor saturați de apă la aceeași temperatură. De regulă, aceasta este
raportul este exprimat ca procent:
Din ecuația lui Mendeleev-Clapeyron (2.6) rezultă că raportul dintre presiunea de vapori este egal cu raportul densităților. Din moment ce ecuația (2.6) însuși, amintesc, descrie vaporii saturați doar aproximativ, avem o relație aproximativă:
Unul dintre instrumentele care măsoară umiditatea aerului este un psihometru. Acesta include două termometre, rezervorul din care unul este înfășurat într-o cârpă umedă. Mai scăzut conținutul de umiditate, cu atât mai intensă evaporarea apei merge din țesut, cu atât mai mare vas de răcire ¾mokrogo¿ termometru și cu atât mai mare diferența dintre citirile și citirile temperaturii sale cu bulb uscat. Pentru această diferență, umiditatea aerului se determină folosind o masă psihometrică specială.
Articole similare
Trimiteți-le prietenilor: