Prepararea acidului clorhidric
Asamblați instrumentul așa cum se arată în figura 49.
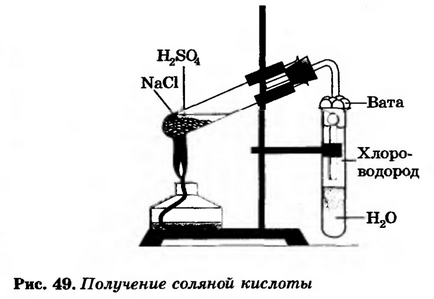
Într-un tub de testare, se toarnă 2-3 g de clorură de sodiu și se adaugă atât de mult acid sulfuric concentrat (2: 1) pentru a uda toată sarea. Închideți tubul de testare cu un tub de evacuare a gazului. Capătul tubului este coborât într-un alt tub de testare cu apă, astfel încât să fie aproximativ 0,5-1 cm de suprafața apei. Apoi, amestecul se amestecă ușor într-un prim tub timp de 5-6 minute (asigurați-vă că acidul nu este transferat într-un al doilea tub cu apă!).
1. Scrieți ecuațiile reacțiilor chimice dintre acidul sulfuric concentrat și clorura de sodiu în condiții normale și sub încălzire puternică.
2. Ce a determinat apariția în cel de-al doilea tub de testare a curenților subțiri?
3. De ce ar trebui ca capătul conductei de gaz să fie la o distanță de 0,5-1,0 cm de suprafața apei?
Studierea proprietatilor acidului clorhidric
Se dizolvă în mod egal acidul clorhidric rezultat în șase tuburi. În primul tub de testare, coborâți piesa de test. În cel de-al doilea tub de testare, puneți o bucată de trompete de zinc sau magneziu, iar în al treilea - o bucată de cupru. În al patrulea tub, adăugați un pic de oxid de cupru (P) și încălziți soluția. În cel de-al cincilea tub introduceți puțin hidroxid de cupru proaspăt preparat (P), în al șaselea - puțină cretă sau alt carbonat.
1. Reacționează acidul clorhidric cu toate metalele? Formați ecuația reacțiilor care au loc între acidul clorhidric și aceste metale.
2. Cum să explicați formarea în a patra și a cincea eprubete de soluții albastre, iar în al șaselea - eliberarea de gaz? Scrieți ecuațiile pentru reacțiile corespunzătoare.
3. Realizați reacții pentru a recunoaște acidul clorhidric și sărurile acestuia. Pentru a face acest lucru, se toarnă 1-2 ml de acid clorhidric diluat într-un tub, al doilea - aceeași soluție de clorură de sodiu, iar a treia - o soluție de clorură de calciu. Se adaugă mai multe picături de soluție de azotat de argint la toate eprubetele. Verificați dacă precipitatul este dizolvat în acid azotic concentrat.
Scrieți ecuațiile reacțiilor dvs. și indicați cum puteți distinge: a) acidul clorhidric din alți acizi; b) clorurile din alte săruri; c) soluțiile de cloruri din acidul clorhidric.
De ce în locul unei soluții de azotat de argint (1) se poate utiliza, de asemenea, o soluție de nitrat de plumb (II)?
Prepararea acidului clorhidric (HCl):

Studiul proprietăților acidului clorhidric:
Pentru a studia proprietățile acidului clorhidric, realizăm câteva reacții caracteristice acestuia.


Articole similare
Trimiteți-le prietenilor: