REACȚII CONTROLATE CU DIFUZIE. p-tion, viteza căreia este determinată de abordarea prin difuziune a particulelor de reacție, după care și mutualitatea lor. apare aproape instantaneu. Reacțiile controlate prin difuziune includ: recombinarea bimoleculară a atomilor și a ionilor în p-rax, recombinarea și disproporționarea radicalilor și a radicalilor ionici. p-tionarea moleculelor cu eliberare liberă. atomi sau radicali într-un solid etc. Kinetica reacțiilor controlate prin difuzie este descrisă de o teorie bazată pe presupunerea aplicabilității la intrări. auto-difuzia moleculelor macroscopice. Fick legile de difuzie; Cu privire la influența transferului de masă a difuziei asupra cineticii chimice. r-tion, a se vedea în art. Macrokinetics. Teoria reacțiilor controlate prin difuzie este folosită pentru a explica numeroasele. procesele asociate cu difuzia microparticulelor: creșterea particulelor coloidale, electrodepunerea. stingerea luminiscenței. arderea difuziei (rolul particulelor difuzate este jucat de agentul de oxidare, care se propagă în mediu - o picătură de combustibil), etc. Kinetic. Caracteristicile reacțiilor controlate prin difuzie sunt ilustrate în mod clar prin exemplul proceselor bimoleculare de tip:
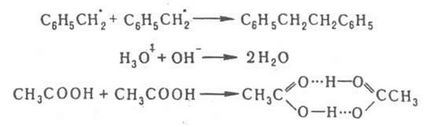
De regulă, astfel de reacții sunt exoterme și au o energie de activare redusă ([10 kJ / mol). Dacă acestea curg în fază gazoasă, viteza lor este determinată de probabilitatea coliziunilor particulelor sau a gazului-cinetic. (vezi, de exemplu, ionii în gaze). În condensator. faza, de ex. în p-re, particulele de reacție A și B, care se ciocnesc cu moleculele p-ritului, se mișcă aleatoriu până când apar într-o celulă structurală a lichidului. O astfel de întâlnire poate fi privită ca formarea unei perechi de difuzie [A. B] ca rezultat al acțiunilor reciproce. auto-difuzia particulelor. P-tionul apare în două consecutive. , în care kD și k'D sunt constantele de viteză ale formării și dezintegrării perechii de difuzie, respectiv. și kC caracterizează rata de conversie a perechii de difuzie la produsele de p-tion. Constanta ratei observate experimental pentru p-TION Koba = ST kD (k'D kC +) - 1 Atunci când condiția k'D >> veniturile kC bimolecuă p-TION în cinetica. mod și knab = kC = KAB. unde KAW = kD / k'D; la kC> kD, procesul este limitat prin difuzie și knab = kD. Pentru prima dată, problema descrierii reacțiilor controlate prin difuzie a fost analizată de M. Smoluchowski în aplicarea la coagularea coloizilor. Cvasi-staționare viteză regim particule de întâlnire A și B: v = 4. 10-3 p DrNA [A] [B] mol / (l s.), Unde D este suma coeficienților. Particulele de difuzie A și B (cm2 / s), r - suma razelor lor (cm), NA - Avogadro constant. Particulele sunt considerate ca sfere, dar lichide. în care difuzează, ca mediu izotrop. Regimul quasiistationar p-tion este stabilit într-un moment t
r 2 / D (în lichide cu viscozitate scăzută t
10 până la 8 până la 10 până la 10 secunde). Dacă forțele de atracție sau repulsie acționează între particule (ioni sau molecule având un moment dipol), în loc de R se folosește așa-numitul. Rază efectivă de întâlnire (Reff):
unde U este potențialul interacțiunilor intermoleculare. k este constanta Boltzmann. T - abs. temp. Coeficienți. difuzia este legată de viscozitatea agentului h. Conform legii Stokes-Einstein, pentru particulele sferice, particule de rază r într-un mediu izotropic D = 10 6 kT / 6 p r h și pentru două particule identice kD = 2.7. 10 3 NA kT / h (l / mol s). Datele experimentale confirmă de obicei dependența kD față de T / h, prezis de acest raport. cu toate acestea, prin abs. Valorile experimentale și calculate ale kD nu coincid întotdeauna. Pentru o coincidență mai bună, ei intră în așa-numitul. mikrotreniya factor f, la-ing depinde de dimensiunile particulelor și moleculele p-ERATOR difuzează și folosind p-lu Stokes - Einstein ca: D = 10 - 6 kT / 6 p r h f. Teoria descrisă face posibilă calcularea constantelor de viteză ale recombinării radicalilor, unii radicali alchil, alcoxi și fenoxi în familii de hidrocarburi, în acord cu experimentul. În cazul reciprocă. a particulelor mari cu un centru de reacție definit (atom sau grup atomic), rata reacțiilor controlate prin difuzie este semnificativ afectată de orientarea reciprocă a particulelor în celula structurală. Favorabile pentru orientarea p-TION a particulelor, precum și întâlnirea lor, datorită rotației în raport cu coliziuni aleatoare dezordonate și, prin urmare, considerate ca un vartej rezultat. și să se comporte. difuzie. Pentru p-tionarea particulelor poliatomice, de regulă, este necesară orientarea lor reciprocă. În acest caz, reactivii posedă o substanță chimică. anizotropie. la-paradis este caracterizat de un steric. factor P [1. Reacția controlată prin difuzie reactivilor tratate chimic ca difuzie controlată anizotrop întâlnire două particule - sfere cu „puncte negre“, atunci când un roi este contactat pete negre. Constanta ratei unei p-TION = 4 kD p10 - 3 DNA Reff l / (mol c.) În cazul în care Reff este asociat cu suma r razelor si particulelor sterich. factorul P prin relația: adică, kD nu este direct proporțional cu P, ca pentru p-tions în faza gazoasă, ci datorită întâlnirilor repetate ale particulelor în celulă. la- transforma particulele însoțite, ceea ce duce la omogenizare R. D iffuzionno controlate reacții metode dezvoltate pentru rapide p-tiile, în special fotoliza pulsului studiat. radioliza impulsului. metodă de iluminare intermitentă. EPR și colab. Constante Rata atomilor și radicalii recombinarea în p-pax au valori de ordinul 10 9 8 l de 10 acompaniat de / (mol. S).
===
App. Literatură: Entlis SG Tiger R. P. Kinetica reacțiilor în faza lichidă, M. 1973; Melvin-Hughes, EA, Echilibrul și cinetica reacțiilor în soluții. per. cu engleza. M. 1975; Ovchinnikov AA Timașev SF Belyi AA Kinetica proceselor chimice controlate prin difuzie, M. 1986. E. T. Denisov.

Articole similare
Trimiteți-le prietenilor: