Încălzirea se realizează atunci când se prelucrează apa inițială în clarificatori cu suspensia de var Ca (OH) 2 calcinată. numit lap de var. Scopul principal al lipsei este de a reduce alcalinitatea apei tratate; În acest caz, se produce o reducere parțială a durității totale a apei tratate, a conținutului de sare, a conținutului de siliciu, a concentrației de compuși ai fierului și, în același timp, apa este îndepărtată din apă.
Esența procesului de calcarare este că atunci când este introdus var, pH-ul apei tratate este mărit la o valoare de 9,5 - 10,3, la care bicarbonații
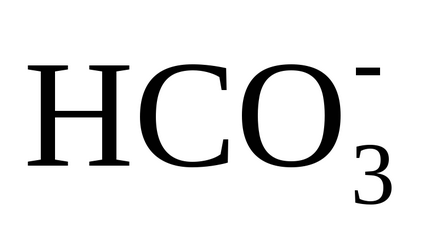
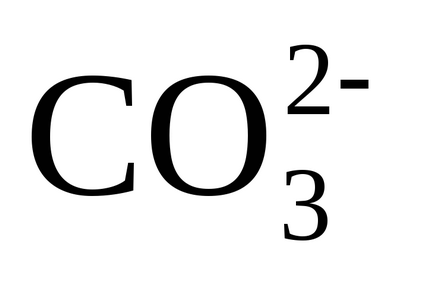
În forma simplificată, apar următoarele reacții în timpul calcării:
1) la intrarea varului, are loc disocierea acestuia, conducând la o creștere a pH-ului
2) Ionii OH - apar în apă. care leagă dioxidul de carbon liber prin transferarea acestuia în ioni de carbonat
3) disocierea ionilor de hidrocarbonat (bicarbonați) are loc prin transferul lor în carbonați
și prin reacția (3) dintr-un singur ion monovalent
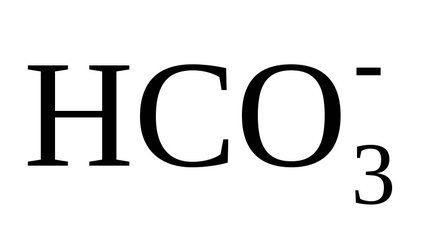
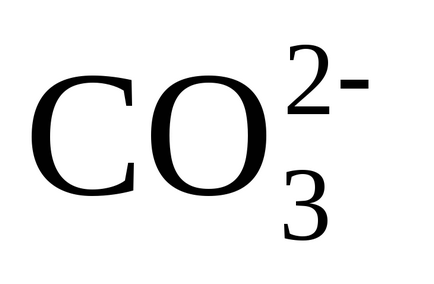
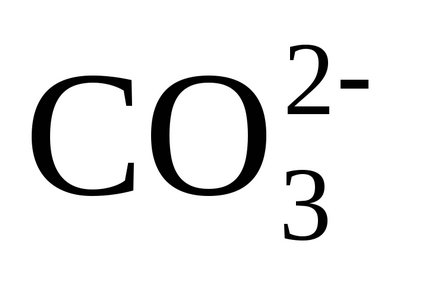
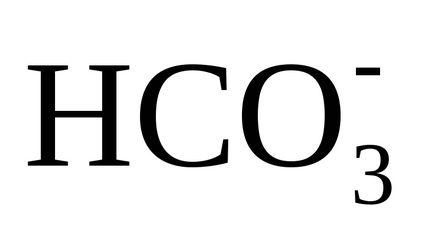
4) precipitarea CaCO3 aproape insolubilă apare când un produs de solubilitate este obținut din carbonat de calciu. deoarece în apă există calciu, așa cum este conținut în apa sursă și introdus cu var și carbonați nou formați
5) când doza de var depășește cantitatea necesară pentru a forma carbonați în apă, apare un exces de ioni de OH - și produsul de solubilitate poate fi depășit
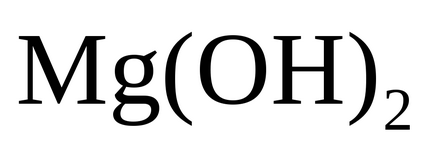
Atunci când se combină calcarea și coagularea ca un coagulant, sulfatul feros este de obicei utilizat într-o doză de Dk. Formarea hidroxidului de fier în timpul calcării necesită un consum suplimentar de var ca sursă de ioni de hidroxid, care ar trebui luată în considerare la calcularea dozei de var:
Reacțiile de mai sus (1-6) permit să se determine doza necesară de var în Liming procesul de alocare, în principal CaCO3 (mod carbonat pH = 9,5) și a crescut cu o doză suplimentară de precipitare var de magneziu sub formă de Mg (OH) 2 ( mod hidratat cu pH = 10,0 - 10.3). În condiții industriale pentru a menține regim de dozare strict var, care asigură absența alcalin hidratat, este practic imposibilă. De obicei, procesul de cenușărire se realizează în modul cu rezidual alcalinitate hidrat hidratat de 0,1 - 0,3 mEq / dm 3 este format dintr-hidrat Nămolul modul având o structură uniformă cu caș mare bine precipite fulgi. Modul de carbonat de suspensie este structura de nisip rezolvă rapid, dar coloana de lichid deasupra interfeței este clarificat rău. Avantajele modului de var hidratat prevede, de asemenea, că prezența hidroxidului de magneziu în tort reducând astfel kremniysoderzhaniya de 25 - 30% din cauza adsorbției ionilor

La determinarea dozei de var, trebuie amintit că, în plus față de cantitatea teoretică necesară de OH - ionilor prin reacțiile (2), (3), (5) bias reacțiile reversibile în direcția corectă, este necesară introducerea unui exces de var în domeniul 0,1 - 0.2 mEq / dm 3, care detectează prezența unui titrabil cenușãrite alcalinitate hidrat de apă, creșterea pH-ului la 10,1 - 10,3 unități și absența virtuală a alcalinității titrabile bicarbonat.
La calcularea dozei de var, este necesar să se ia în considerare compoziția ionică a apei tratate. Pentru utilizare practică, doza calculată de calcar Di. mg-equv / dm 3. Este determinat pentru majoritatea tipurilor de apă pentru care

Supradozajul de var în raport cu proporția de Mg 2+ izolat în magneziu în regimul hidratat nu este însoțit de o scădere a rigidității și a alcalinității, dar determină înlocuirea rigidității non-carbonatului de magneziu cu calciu în reacție
.
Până când au trecut toate etapele de limpezire, alcalinitatea carbonatului rezidual (adică suma
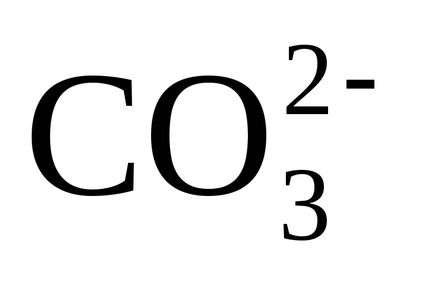
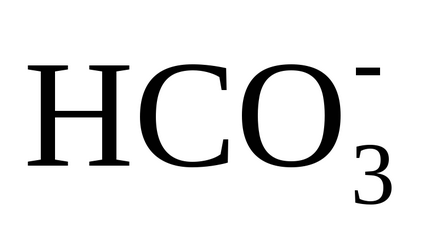
Deteriorarea rezultatele reale ale concentrațiilor de alcalinitate ale Ca2 + (0.15-.3 meq / dm 3) și Mg 2+ (0,1 - 0,15 mEq / dm 3) în timpul Liming în comparație cu echilibrul valorilor asociate influenței factorilor cinetici: mai degrabă cristalizeze lent CaCO3 solid rezultat și Mg (OH) 2, atunci când sistemul se apropie de echilibru, și rolul „inhibare“ a mixturi organice (coloizii de protecție) a apei originale, precum și cu eliminarea brightener microcristalina fază solidă.
Articole similare
Trimiteți-le prietenilor: