Culoare conform Tsil-Nielsen.
1. fix acoperit cu frotiu fâșia flacără de hârtie de filtru, se toarnă pe soluție fucsin Guides și încălzite; la apariția vaporilor, opriți încălzirea și lăsați vopseaua pe preparat timp de câteva minute (2-3 minute). După ce ați lăsat medicamentul să se răcească, scoateți hârtia cu pensete și spălați tamponul cu apă.
2. Decolorați preparatul cu soluție apoasă de acid sulfuric 5-10% timp de 3-5 secunde (până la nuanța gălbuie a frotiului). În loc de acid sulfuric, puteți aplica o soluție de 5% de azot sau soluție 3% de acid clorhidric.
Frotiul se spală bine cu apă.
5. Se spală din nou cu apă.
6. Colorant timp de 3-5 minute, albastru de metilen de la Leffler sau soluție apoasă 1: 1000 de verde malachit sau verde de metil.
7. Vopseaua este clătită cu apă și preparatul este uscat.
Frotiurile: TB bacillus - rubin roșu, iar restul, cu excepția agentului cauzal paratuberculosis, acidul - și alcool evacueze saprofitele - albastru. Pentru albirea frotiu de colorare cu Ziehl-Neelsen în loc de acizi și alcool, în special recomandat să consume alcool clorhidric (3 ml de acid clorhidric + 96 ml de 97 ° alcool) la rozalie nuanță medicament apreciabil. După aceasta, frotiul este clătit cu apă și colorat cu albastru de metil, etc., în conformitate cu prescripția de bază. Această metodă realizează testarea simultană a bacililor pentru rezistența la acid și alcool. Printre tipurile de saprofite acidorezistente găsit specii spirtopodatlivye, bacilul tuberculozei și paratuberculosis este întotdeauna acidul - și alcoolul.
Lecția 4. Colorarea bacteriilor care formează spori și a capsulelor. Determinarea mobilității microorganismelor.
Scopul lecției. Aflați metodele de colorare a formării de spori, bacterii care formează capsule, precum și determinarea mobilității bacteriilor.
Materiale și echipamente. Suspensiile de bacterii vaccin tulpina antrax, clostridium, gata de utilizare preparate de bulion de cultură de bacterii capsulă de Escherichia mobile creștere 18 oră, diapozitive și capacul de sticlă, afișe, soluție safranina 2%, o soluție apoasă de soluție de malachit verde Ziehl lui.
Instrucțiuni metodice. Fiecare elev pregătește frotiuri din suspensii de microorganisme și le pătrunde prin metoda Trujillo, Olta, microscoape și schițe; pregătește un preparat pentru studierea mobilității microorganismelor utilizând metoda picăturilor "zdrobite" și "agățate".
Sporul de colorare. În condiții nefavorabile pentru microbiene (lipsa mediu nutritiv, uscare și alte temperaturi nefavorabile.) În citoplasmă anumitor sporilor microbieni sunt formate. Ele sunt formate în interiorul celulei vegetative, fiind endospori. Formă de tijă Gram-pozitive microorganisme care formează sporii sunt rotunde, cu diametrul care nu depășește lățimea celulelor microbiene aparțin roduBacillusi numite bacili. Microorganismele din genul Clostridium au spori al căror diametru depășește lățimea celulei microbiene și se numește clostridie. Ele sunt ovale și rotunde în formă (Figura 5).
Disputele sunt rezistente la temperaturi ridicate, substanțe chimice, la uscare și persistă în sol pentru o lungă perioadă de timp, ceea ce se explică prin structura lor specială și compoziția chimică, în special cochilii. Prin urmare, disputele sunt rezistente la acțiunea coloranților.
Toate metodele de colorare a sporelor se bazează pe asigurarea penetrării vopselei prin carcasa greu de colorat a sporii. Prin urmare, aplicați un mordant. După răcire, carcasa devine din nou densă și nu trece un colorant suplimentar.
Tehnica de spori de colorare prin metoda Trujillo. Pe un frotiu fix, se aplică o mică bucată de hârtie de filtru și se aplică o soluție apoasă de verde malachit.
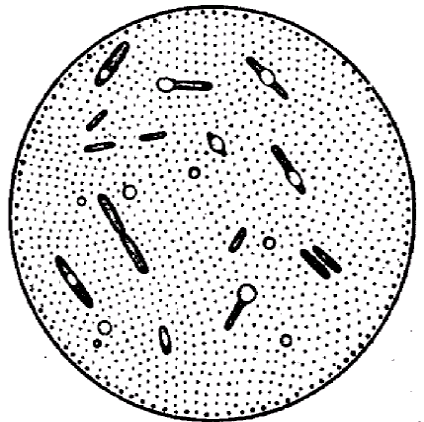
Preîncălzi preparatul pe flacăra arzătorului până la apariția fumului și stați timp de 3 minute, spălați cu apă și colorați cu o soluție apoasă de magenta de bază 0,25% pentru 1 minut. Clătiți cu apă și uscați. Micro-imagine: sporii sunt verzi, iar celulele vegetative sunt roșii.
Colorarea capsulelor. Corpul celulei microbiene este acoperit cu un strat de mucoasă liberă. La unele specii de microorganisme acest strat se dezvoltă foarte puternic și apoi se numește o capsulă. Capsule - substanța asemănătoare mucinei, polizaharidă moleculară ridicată, este un derivat al stratului exterior al cochiliei. Prezența capsulei este un indicator important de diagnostic în identificarea agenților patogeni și diferențierea anumitor infecții (antrax, pneumonie pneumococică, etc.) (Fig. 6). Microorganismele patogene formează o capsulă în organismul infectat. Este un factor de virulență și protejează celula bacteriană de fagocitoză și acțiunea bactericidă a serului de sânge. Capsula este slab colorată. Prin urmare, la pregătirea preparatului pentru detectarea capsulelor, sunt îndeplinite următoarele reguli:
a) se prepară un frotiu din material proaspăt, deoarece capsula este lizat rapid;
b) fixarea frotiului chimic; pentru vopsire se aplică vopsele metochromatice, adică, atunci când se utilizează, care este citoplasma vopsită într-o singură culoare, iar capsula - în alta;
c) clătirea frotiului cu apă trebuie să fie slabă și pe termen scurt.
Tehnica de colorare a capsulelor prin metoda Olt. O soluție proaspătă de safran 2% fierbinte se aplică pe un frotiu fix, colorat timp de 5-7 minute. Se spală rapid cu apă și se usucă. Corpul celular este vopsit în cărămidă roșie, capsulă în galben-portocaliu. Determinarea mobilității bacteriilor.
Mobilitatea mobilității este o caracteristică importantă a speciei și se realizează în studii de diagnosticare: rezultatul este luat în considerare la identificarea microorganismelor. La speciile mobile, capacitatea mișcării independente de translație (și de rotație) se datorează prezenței formelor de flagelă speciale - subțiri asemănătoare cu firele.
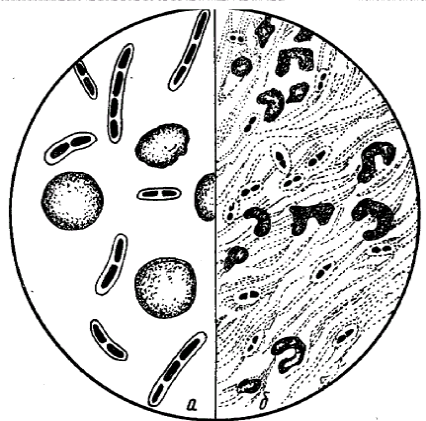
Fig. 6. Capsula în bacteriile a - bacilul de antrax; b - diplococ
Flagelul de diferite lungimi.
Diametrul lor este atât de mic, încât este invizibil într-un microscop ușor (mai mic de 0,2 microni). În diferitele grupuri de bacterii, numărul și localizarea flagelului nu sunt aceleași. Flagella este puțin percepută de coloranți. Metodele de colorare complexă denaturează forma originală de flagelă, astfel încât în laboratoare nu se efectuează culoarea flagelui, dar bacteriile sunt examinate într-o stare vie. În funcție de locația și numărul de flageluri, microbii sunt împărțiți (figura 7):
a) monotrihi - microorganisme având pe unul dintre polii unei mișcări flagellum activă, progresivă (Pseudomonas);
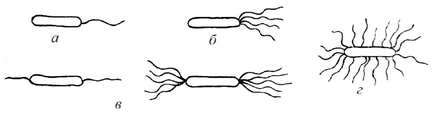
Fig. 7. Tipuri de localizare a flagelului în bacterii
b) Lofotriha - microbi, având pe unul din stâlpi un pachet de flagel (listeria);
c) amfitrificii - microbi care au flagel la ambii poli ai celulei microbiene;
d) Peritrichi - microbi, în care flagella se află pe întreaga suprafață a celulei (E. coli).
Există specii de microorganisme care au mobilitate, dar nu au flagelă (spirochete, leptospira). Miscarea lor este cauzata de contractiile impulsive ale aparatului fibrilar motor al celulei microbiene.
Pentru a determina mobilitatea bacteriilor, este necesar să se folosească o cultură nu mai veche decât vârsta diurnă, deoarece culturile vechi își pierd capacitatea de a se mișca.
Determinarea mobilității bacteriilor prin metoda "drop drop". O picătură de cultură de bacterii cu o bucle bacteriologică (18-20 ore) se aplică pe geamul de acoperire. lamelă de sticlă specială, cu o degajare (lune) este acoperită cu o picătură de cultură, astfel încât sticla de acoperire cu o scădere a fost în centrul semicercului și lipit de diapozitive (marginea pre-lune usor uns cu vaselina). De droguri este întoarsă cu susul în jos, și picătură "atârnă" peste lunar (Figura 8). Preparatul este microscopat cu un câmp de vedere întunecat, mai întâi pentru un câmp mic, apoi pentru o mărire medie sau mare. Pe fundalul luminii, microbii sunt de culoare gri închis. Prin metoda lui Shukevich. În acest scop, o picătură de suspensie bacteriană este aplicată condensului teșită mediu nutritiv solid in vitro. Mutarea microorganismelor, care se deplasează de la condens, cresc pe suprafața mediului; speciile staționare se înmulțesc numai în condensatul mediului ("nu intră" pe suprafața agarului).
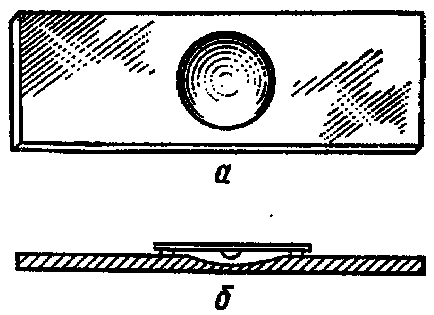
Fig. 8. Investigarea microbilor pentru mobilitate a - sticlă cu un bol mic; b - "picătură suspendată"
Metoda este o "picătură zdrobită". O picătură de suspensie bacteriană este aplicată la un diapozitiv convențional, acoperită cu atenție cu o alunecare a capacului și ușor apăsată cu un deget. Se efectuează microscopia, precum și metoda "drop drop".
Metoda de inoculare într-un agar semisolid. Pentru această cultură buclă inoculată bacteriologică în studiu la înțepătură de jos a tubului cu un mediu nutritiv semi-lichid. Cultura mobilă crește pe tot mediul, care formează turbiditate uniformă și fixă - înțepătură numai pe o porțiune de tijă menținând în același timp mediu de transparență neinoculat.
SESIUNEA 5. Ustensile de laborator și pregătirea acestora. Suplimente nutritive. Metode de preparare și sterilizare a mediilor nutritive. Metode de sterilizare a articolelor de laborator din sticlă.
Scopul lecției. Pregătiți vasele. Pregătiți mediile nutritive. Determinați pH-ul mediilor. Să se familiarizeze cu metodele de sterilizare a mediilor nutritive și a ustensilelor de laborator.
Echipamente și materiale. Standuri, tuburi de testare, bucle microbiologice, pipete, vase Petri, hârtie. Autoclave, cabină de uscare. Un set de medii și reactivi chimici. pH-metru.
Articole similare
Trimiteți-le prietenilor: