Teoria structurii chimice
O structură chimică este secvența combinației de atomi într-o moleculă și aranjamentul reciproc în spațiu. Schimbarea acestei secvențe duce la formarea unei noi substanțe cu proprietăți noi.
Principalele prevederi ale teoriei structurii chimice:
1. Proprietățile substanțelor sunt determinate de compoziția lor calitativă și cantitativă și de structura chimică.
2. Atomii din moleculă sunt conectați în funcție de valența lor.
3. Atomii și grupurile de atomi dintr-o moleculă se afectează reciproc, acest efect fiind slăbit în momentul în care sunt îndepărtați.
Teoria structurii chimice este dezvoltată de A.M. Butlerov și studenții săi în a doua jumătate a secolului XIX.
Legarea chimică. Caracteristicile principale ale lipirii chimice
O legătură chimică este interacțiunea care deține atomi în molecule și determină stabilitatea moleculelor în anumite condiții.
Caracteristicile principale ale lipirii chimice:
Energia de comunicare (ERU) este energia minimă necesară pentru a rupe comunicațiile.
Se măsoară în electron-volți (eV) pentru o conexiune sau în kJ / mol pentru un mol de legături. Energia de legare este o caracteristică a rezistenței legăturii - cu cât energia de legare este mai mare, cu atât este mai puternică legătura.
Lungimea legăturii (LSB) este distanța dintre nucleele atomilor legați. Măsurată în nanometri (nm) sau în angstromuri (A). Cu cât conexiunea este mai scurtă, cu atât mai mult este, de regulă, mai puternică.
Saturarea legăturii - dacă atomul formează un număr finit de legături cu alți atomi (de obicei nu mai mult de 8) - legătura este saturată, dacă este infinit de mare (mai mult de 1000) - este nesaturată.
Directivitatea comunicării - dacă există anumite direcții în spațiul de-a lungul căruia se extinde acțiunea comunicării, atunci conexiunea este direcționată, dacă nu există astfel de direcții, atunci nu este direcționată.
Energia și lungimea legăturii sunt caracteristice pentru orice legătură chimică, saturația și directivitatea depind de tipul de legătură.
Legătura covalentă
Legătura covalentă - legătura dintre atomi datorită perechilor electronice comune.
Când se converg doi atomi de hidrogen, sunt posibile două cazuri:
1. Pe măsură ce forțele de repulsie dintre atomi se apropie reciproc, ele cresc pe o perioadă nedeterminată (curba 1), în timp ce energia sistemului crește și sistemul nu poate fi stabil.
2. repulsive forță înlocuite atracție forțe care ating nivelul lor maxim atunci când distanța dintre nuclee egal ro (curba 2), energia sistemului în această stare, minimul și mai puțin decât energia totală a atomilor inițiali.
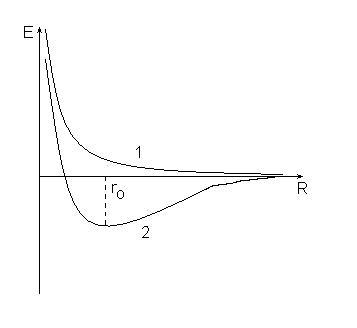
Această diferență în comportamentul atomilor este cauzată de diferite valori ale numărului de spin quant pentru electronii din atomii originali. Dacă rotirile electronilor au fost aceleași, atunci aceasta este curba 1, dacă este diferită - apoi 2:
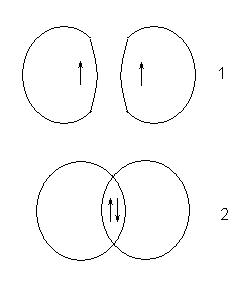
Statul care apare în acest caz corespunde unui sistem stabil în care există o regiune cu o densitate de electron crescută între nucleele atomilor. Această regiune compensează repulsia reciprocă a nucleelor și se numește regiunea suprapusă a orbitalilor sau o pereche electronică comună.
Astfel se formează o moleculă de hidrogen. Deoarece orientarea spinului unui electron intr-un atom de hidrogen este la fel de probabila (jumatate din atomi au un electron cu spin +1/2, jumatate -1/2), atunci cand hidrogenul molecular este format dintr-un atom atomic, toti atomii formeaza molecule.
Adesea, acest proces este reprezentat sub forma unui circuit, care denotă electronii prin puncte:
și o pereche electronică comună - o linie:
Legătura covalentă este formată din două mecanisme - schimb. când fiecare dintre atomii care participă la formarea legăturii furnizează un electron (A) și un electron donor-acceptor pentru o pereche electronică comună. atunci când donatorul dă o pereche de electroni și acceptorul este o orbitală liberă (B). Figura arată schemele acestor mecanisme și reacțiile reale corespunzătoare care le corespund:
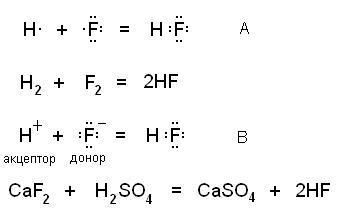
Moleculele rezultate nu diferă în vreun fel unele de altele.
Legătura covalentă polară și nepolară
Prin simetrie de distribuție a încărcăturii, legăturile covalente sunt împărțite în cele polare și nepolare.
Dacă perechea electronilor obișnuiți (regiunea suprapusă a orbitalilor) este localizată simetric în raport cu nucleele conectate, legătura se numește nonpolară covalentă dacă este deplasată spre unul dintre nuclee, polar covalent.
O legătură covalentă nepolară apare între atomii aceluiași element și datorită simetriei distribuției de sarcină, legătura nu are un moment dipol. Exemple de molecule cu o legătură covalentă nepolară: H2. O2. F2, Cl2. N2. AG2.
Dacă implicată în legarea atomilor de diferite electronegativitate, există o legătură covalentă polară. Perechea de electroni totală este deplasată spre atomul cu o mai mare electronegativitate, asimetria care rezultă în distribuirea taxelor duce la apariția unei conexiuni dipol momenta.Chasto ofset pereche de electroni prezintă o săgeată, de exemplu:
Simbolul desemnează taxele dipol, care pot fi mai mici decât încărcarea electronică, dar există numai împreună.
Electronegativitatea atomului de carbon depinde de hibridizarea sa, tabela de comparație dă electronegativitatea relativă a unor atomi și a stărilor hibride de carbon:
- și -connection
- și-link-urile se disting prin simetria suprapunerii orbitalilor.
Dacă linia care leagă nucleele atomilor legați trece prin regiunea suprapusă a orbitalilor, legătura se numește "legătură", dacă regiunea suprapusă se află departe de această linie prin legare.
-legăturile se formează prin suprapunerea sb-urilor orbitale ale atomilor (A), orbitalelor p-p (B), orbitalelor s-p (C) și orbitalilor hibrizi:
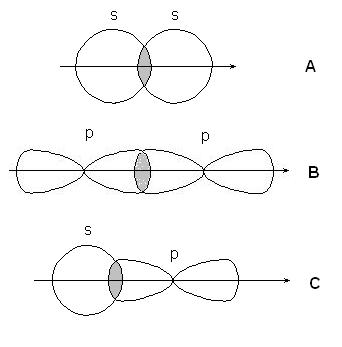
-conexiune - atunci când suprapunerea p-p orbitalilor:
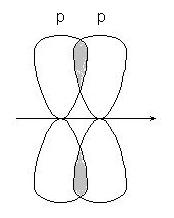
sau orbitale p-d:
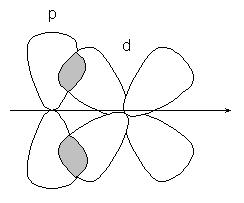
-comunicarea este mai puțin durabilă decât conexiunea, iar electronii ei sunt mai ușor expuși influențelor externe. În compușii având legături multiple, numai una dintre legăturile este -cvyazyu format prin suprapunerea s, p sau hibrid orbitali, iar restul - -bond formate prin suprapunerea p non-hibridizate - orbitalii de atomi, de exemplu, dublă legătură formate orbitali hibride (-bond) și nu care participă la hibridizarea cu p-orbite (-lincă):
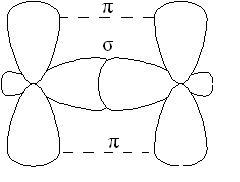
In moleculele de alchene, în special etilena, atomii de carbon de la dvoynoysvyazi sunt în sp2 hibridizare, minciună toate C-H EC-C -bond într-un singur plan, se suprapun p orbitalii nonhybrid atomilor uglerodaproiskhodit într-un plan perpendicular pe -bonds plane. Uneori acest avion este numit planul de conexiune:
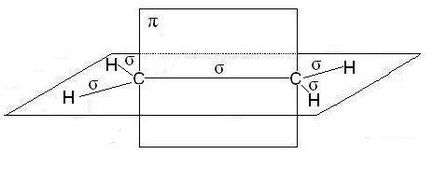
În cazul legăturii triple, cum ar fi moleculele de alchine, cum ar fi acetilena, atomii de carbon sunt în comunicare sp-hibridizare Două -bond formate suprapuse p orbitalii nonhybrid de atomi de carbon (două din fiecare) se află în două planuri reciproc perpendiculare:
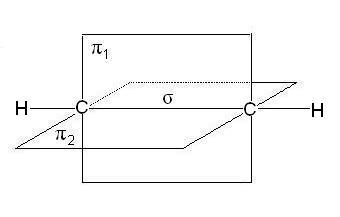
Tabelul prezintă principalele caracteristici ale legăturilor dintre atomii de carbon:
Legătură hidrogen
Legătura de hidrogen este formată printr-un mecanism donor-acceptor între un atom de hidrogen conectat la un atom electronegativ și un atom având o pereche de electroni neparticipați, de exemplu:
Hidrogenul legat la un atom de carbon este incapabil de formarea legăturii de hidrogen.
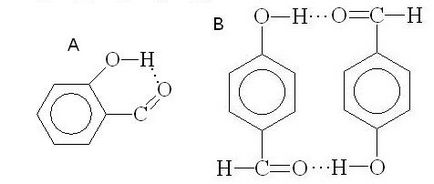
energia legăturii de hidrogen este mică (10-40 kJ / mol), aceasta este totuși afectează în mare măsură proprietățile fizice și chimice ale compușilor. Compusul cu legături de hidrogen intermoleculare sunt de fierbere mult mai mare decât compușii cu aceeași greutate moleculară, dar care nu sunt asociate prin legături de hidrogen. De exemplu, temperatura de fierbere a etanolului (78,3 ° C), este mult mai mare decât punctul de fierbere al dimetil eter (24 ° C). Dimpotrivă, legăturile intramoleculare cu hidrogen pot duce la o scădere a punctului de fierbere. De exemplu, o-salicilaldehidă (A, intramoleculară legături de hidrogen) are o volatilitate mai mare în comparație cu p - hidroxibenzaldehidă (B al legăturii de hidrogen intermoleculară):
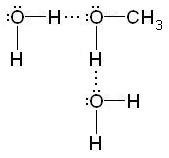
Formarea legăturilor de hidrogen explică solubilitatea multor compuși organici în solvenți polari. De exemplu, hidratarea alcoolilor inferiori are loc în soluție apoasă:
Legăturile de hidrogen joacă un rol imens în formarea structurii spațiale a proteinelor, a carbohidraților și a acizilor nucleici.
Articole similare
-
Chimie pentru tipurile de păr lung, tehnologie, fotografii și clipuri video
-
Caracteristicile generale ale căilor navigabile (în, mn, gdp)
Trimiteți-le prietenilor: