Legea distribuției uniforme a energiei în grade de libertate: energia moleculei este distribuită uniform în funcție de gradele de libertate, adică pentru fiecare grad de libertate, indiferent de structura moleculei, există aceeași energie egală cu kT / 2.
Ecuația Clausius
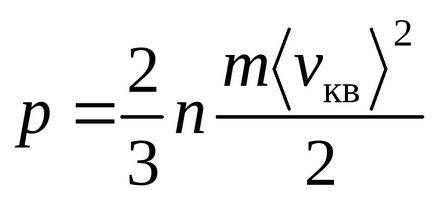
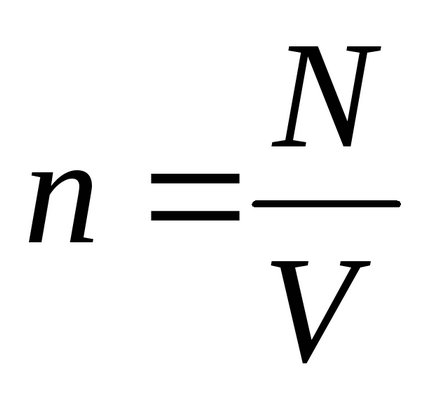

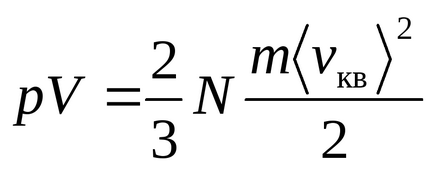
Ecuația lui Mendeleev-Clapeyron
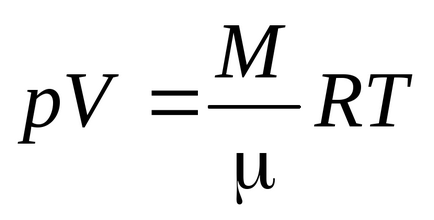

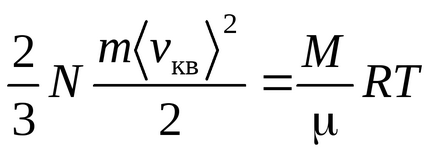

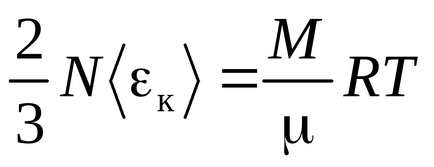

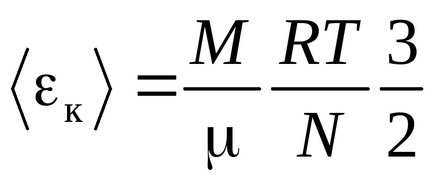
Ecuația Clausius a fost obținută presupunând că moleculele de gaz sunt puncte materiale (molecule monatomice) având 3 grade de libertate a mișcării translaționale. Deoarece toate direcțiile de mișcare sunt la fel de probabile, energia totală a moleculei este distribuită în mod egal între cele trei grade de libertate și pentru fiecare grad de libertate există energii kT / 2
Energia unei molecule:
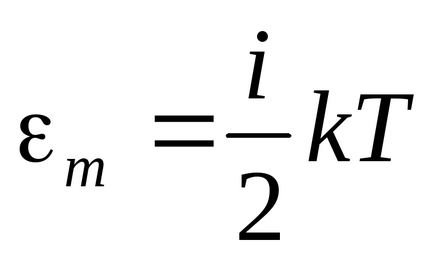
Energie de un kilometru :.
Energia unei mase arbitrar de gaz
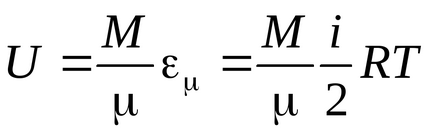
3. Lucru și căldură. Capacitatea de căldură, tipurile acesteia.
Lucrare elementară. Gazul produs prin deplasarea pistonului în segmentul dh,
Lucrarea efectuată cu o schimbare finită a volumului de gaze de la V1 la V2,
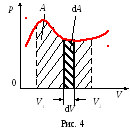
Dacă dV> 0, atunci dA> 0: sistemul execută lucrări pe corpuri externe - le dă o parte din energia sa.
Dacă dV <0, то dA <0: внешние тела совершают над системой работу – система получает энергию извне.
Din punct de vedere grafic, lucrarea este reprezentată în coordonatele p și V (diagrama de lucru) cu o zonă delimitată de curba p = f (V) și două ordonate corespunzătoare volumului inițial V1 și volumului final V2.
Transferul energiei termice (căldură) este însoțit de o schimbare a temperaturii corpului. Pentru a caracteriza capacitatea corpurilor de a-și crește temperatura datorită căldurii primite din exterior, se introduce conceptul de capacitate termică.
Căldura specifică C este o cantitate fizică scalară care caracterizează relația dintre cantitatea sistemului de încălzire raportat și modificarea temperaturii sale.
Tipuri de capacitate termică
Capacitatea totală de încălzire a Spol este egală numeric cu cantitatea de căldură care trebuie raportată sistemului în scopul creșterii temperaturii cu un grad
Capacitatea de căldură molară Cμ este numeric egală cu cantitatea de căldură pe care un kilometru de materie trebuie raportată pentru a crește temperatura cu un grad:
Căldura specifică (c) este numeric egală cu cantitatea de căldură care trebuie raportată la masa unității de materie pentru a crește temperatura cu un grad:
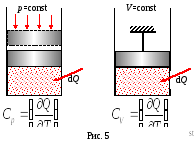
În funcție de natura procesului, capacitățile de căldură se disting pentru un volum constant CV și la o presiune constantă Cr.
Sensul fizic al lui R este lucrarea de extindere a 1 mol de gaz ideal în procesul izobaric atunci când este încălzit cu 1 K
Trimiteți-le prietenilor: