În lecția 25 "Actul Boyle-Mariott" din cursul "Chimie pentru manichiuri" se ia în considerare legea privind presiunea și volumul gazului, precum și graficele de presiune față de volum și volum față de presiune. Permiteți-mi să vă reamintesc că în ultima lecție "Presiunea gazului" am considerat dispozitivul și principiul acțiunii barometrului de mercur și am definit presiunea și am examinat unitățile sale de măsură.

Robert Boyle (1627-1691), căruia îi datorăm prima definiție în mod substanțial corectă a elementului chimic (aflați în cap. 6), am fost interesat de fenomenele care au loc în vasele de sânge cu aer subțire. Inventarea pompe de vid pentru pomparea aerului din vase închise ermetic, el a atras atenția asupra proprietății, familiar pentru oricine care sa întâmplat cu vezica urinara minge de fotbal sau de a strânge ușor balonul: mai mult comprimat aerul într-un vas închis, cu atât mai mult rezistă compresie. Boyle a numit această proprietate "elasticitatea" aerului și a măsurat-o folosind un dispozitiv simplu, prezentat în Fig. 3.2, a și b.

Boyle blocat mercur puțin aer în capătul închis al tubului îndoit (Fig. 3-2, precum și) și apoi stoarcere aer, adăugând treptat mercurul în capătul deschis al tubului (Fig. 3-2 B). Presiunea suferită de aer în porțiunea închisă a tubului este egală cu suma presiunii atmosferice și de mercur la presiune înălțimea coloanei h (h - înălțimea la care nivelul de mercur în capătul deschis al tubului depășește nivelul mercurului în capătul închis). Datele obținute de Boyle pentru măsurarea presiunii și a volumului sunt prezentate în tabelul. 3-1. Deși Boyle nu a luat măsuri speciale pentru a menține temperatura constantă a gazului, aparent, în experimentele sale sa schimbat doar puțin. Cu toate acestea, Boyle a observat că căldura de la flacăra lumânării a provocat schimbări semnificative în proprietățile aerului.
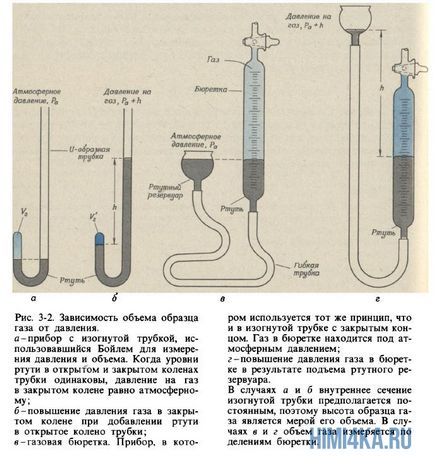
Analiza presiunii aerului și volumul de date când este comprimat
Tabelul 3-1. care conține datele experimentale ale lui Boyle privind relația dintre presiune și volum pentru aerul atmosferic, este situat sub spoilerul.


După ce cercetătorul primește date, similare cu cele listate în Tabelul. 3-1, el încearcă să găsească o ecuație matematică. conectând două cantități dependente reciproc, pe care le măsura. O modalitate de a obține o astfel de ecuație este de a construi grafic dependența diferitelor grade de o magnitudine de alta în speranța de a obține un grafic rectiliniear. Ecuația generală a unei linii drepte are forma:
unde x și y sunt variabile înrudite, iar a și b sunt numere constante. Dacă b este zero, linia dreaptă trece prin origine.
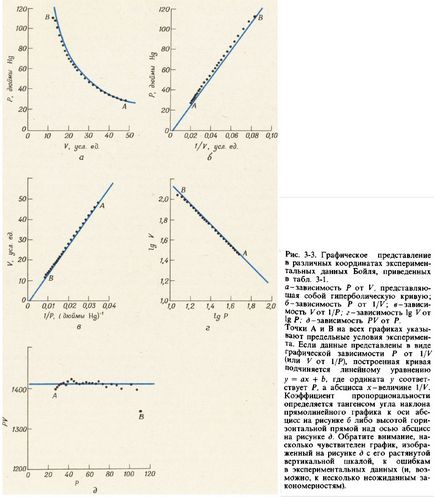
În Fig. 3-3 prezintă diferite metode de reprezentare grafică a datelor pentru presiunea P și volumul V, prezentate în Tabelul. 3-1. Graficele dependenței lui P de 1 / K și dependența V pe 1 / P sunt linii drepte care trec prin origine. Graficul grafic al dependenței logaritmului P de logaritmul V este, de asemenea, o linie dreaptă cu o pantă negativă a cărei tangență de unghi este -1. Toate aceste trei grafice duc la ecuațiile echivalente:
Fiecare dintre aceste ecuații reprezintă una dintre variantele legii Boyle-Marriott. care este formulată de obicei după cum urmează: pentru un anumit număr de moli de gaz, presiunea sa este proporțională cu volumul, cu condiția ca temperatura gazului să rămână constantă.
Apropo, cu siguranță te-ai întrebat de ce legea lui Boyle-Mariott este numită dublu nume. Acest lucru sa întâmplat deoarece această lege, independent de Robert Boyle, care la deschis în 1662, a fost redescoperită de Edm Mariott în 1676. Aici și așa mai departe.
Atunci când relația dintre cele două cantități măsurate este simplă în măsura în care, în acest caz, poate fi stabilită într-un mod numeric. Dacă fiecare valoare a presiunii P este înmulțită cu valoarea corespunzătoare a volumului V, nu este dificil să se verifice dacă toate produsele pentru o anumită probă de gaz la o temperatură constantă sunt aproximativ aceleași (vezi tabelul 3-1). Astfel, se poate scrie asta
Ecuația (3-3) descrie relația hiperbolică dintre cantitățile P și V (vezi figura 3-3, a). Pentru a verifica dacă produsul P · V grafic construit din datele experimentale privind dependența P V corespunde efectiv hiperbolă construct program mai suplimentar în funcție de P și verificați dacă acesta este o linie dreaptă orizontală (vezi. Fig. 3-3, d) .
Boyle a constatat că pentru o anumită cantitate de orice gaz la o temperatură constantă, relația dintre presiunea P și volumul V este destul
descrise în mod satisfăcător de relația
- P · V = const (la constanta T si n) (3-4)
Formula din legea lui Boyle-Mariotte
Pentru a compara volumele și presiunile aceleiași probe de gaz în condiții diferite (dar cu o temperatură constantă), este convenabil să reprezentăm Legea lui Boyle-Mariotte în următoarea formulă:
unde indiciile 1 și 2 corespund celor două condiții diferite.
Exemplul 4 este livrat la pungile de plastic Colorado Platoul cu produse alimentare (vezi. Exemplul 3), adesea de spargere, deoarece aerul captiv în interior, în timpul ridicării de la nivelul mării până la o altitudine de 2500 m în condiții de presiune atmosferică scăzută, se extinde. Dacă se presupune că în interiorul pungii sub presiune atmosferică corespunzătoare nivelului mării, se încheie cu 100 cm3 de aer, ce volum trebuie să ia acest aer la aceeași temperatură pe platoul Colorado? (Să presupunem că produsele sunt folosite pentru a furniza pungi încrețite, fără a limita expansiunea aerului, datele care lipsesc trebuie luate din exemplul 3.)
Soluția
Utilizăm legea lui Boyle sub forma ecuației (3-5), unde indicele 1 va fi referit la condițiile de la nivelul mării și indicele 2 la condițiile la o altitudine de 2500 m deasupra nivelului mării. Apoi P1 = 1.000 atm, V1 = 100 cm 3. P2 = 0.750 atm, și V2 ar trebui să fie calculate. Și așa,
Trimiteți-le prietenilor: