Cuprins
electronegativitate
În chimie, conceptul de electronegativitate (EO) este utilizat pe scară largă - proprietatea atomilor unui element dat de a trage electroni pe sine din atomii altor elemente din compuși se numește electronegativitate. Electronegativitatea litiului este luată în mod obișnuit ca unitate, EO a celorlalte elemente este calculată în consecință. Există o scară de elemente EO.
Valorile numerice ale elementelor EO au valori aproximative: aceasta este o cantitate fără dimensiuni. Cu cât este mai mare valoarea EO a elementului, cu atât sunt mai pronunțate proprietățile sale nemetalice. Prin elementele EO se pot scrie următoarele:
F> O> Cl> Br> S> P> C> H> Si> Al> Mg> Ca> Na> K>

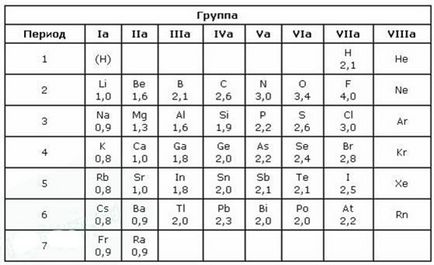
Cea mai mare valoare a EO este fluor. Comparând valorile elementelor EO din Franța (0.86) cu fluorul (4.1), este ușor de observat că EO este supusă Legii periodice. În tabelul periodic de elemente, EO în perioada crește cu numărul elementului (de la stânga la dreapta), iar în principalele subgrupuri scade (de sus în jos). În perioadele în care încărcăturile nucleelor atomice cresc, numărul de electroni de pe stratul exterior crește, raza atomilor scade, astfel încât ușurința de recul a electronilor scade, crește EO și, în consecință, crește proprietățile nemetalice.
Diferența dintre electronegativitatea elementelor din compus (ΔX) ne va permite să judecăm tipul de legătură chimică.
Dacă valoarea ΔX = 0, legătura covalentă este nepolară.
Cu o diferență de electronegativități de până la 2.0, legătura se numește polar covalent. de exemplu: legătura H-F în moleculă fluorhidrat HF: ΔX = (3,98-2,20) = 1,78
Legăturile cu o diferență de electronegativități mai mare de 2,0 sunt considerate ionice. De exemplu: legătura NaCl în compusul NaCl: ΔX = (3,16 - 0,93) = 2,23.
Electronegativitatea depinde de distanța dintre nucleul și electronii de valență și de cât de mult cochilia de valență este aproape de cea finalizată. Cu cât raza unui atom este mai mică și cu cât sunt mai mulți electroni de valență, cu atât eO este mai mare.
Fluorul este cel mai electronegativ element. Mai întâi, are 7 electroni pe shell-ul valenței (până la un octet lipsește doar un electron) și, în al doilea rând, această cochilie de valență este situată aproape de nucleu.
Electronegativitatea poate fi exprimată cantitativ și poate să consolideze elementele într-un rând prin creșterea acesteia. Cel mai frecvent utilizat este scala de electronegativitate propusă de chimistul american L. Pauling.
Grad de oxidare
Substanțele complexe constând din două elemente chimice sunt numite binare (din bi-două latine) sau două elemente (NaCl, HCl). În cazul unei legături ionice în molecula de NaCl, atomul de sodiu transferă electronul său extern la atomul de clor și este transformat într-un ion cu încărcătura +1, iar atomul de clor are un electron și devine un ion cu o sarcină de -1. Schematic, procesul de conversie a atomilor în ioni poate fi reprezentat după cum urmează:
În interacțiunea chimică în molecula de HCI, perechea electronică totală se îndreaptă spre un atom mai electronegativ. De exemplu, electronul nu se transferă complet de la atomul de hidrogen la atomul de clor și, parțial, determină o încărcare parțială a atomilor δ: H +0,18 С1 -0,18. Dacă ne imaginăm că în moleculă de HCI, ca în clorura de NaCI, electronul a trecut complet de la atomul de hidrogen la atomul de clor, ar fi primit sarcini de +1 și -1:
Astfel de taxe condiționale se numesc gradul de oxidare. Pentru a determina acest concept, se presupune în mod convențional că, în compușii polari covalenți, electronii de legare s-au deplasat complet la un atom mai electronegativ și, prin urmare, compușii constau numai din atomi încărcați pozitiv și negativ.
Gradul de oxidare este o sarcină condiționată a atomilor unui element chimic din compus, calculată pe baza presupunerii că toți compușii (atât ionici cât și covalent-polari) constau numai din ioni. Gradul de oxidare poate avea o valoare negativă, pozitivă sau zero, care de obicei este plasată deasupra simbolului elementului de sus, de exemplu:
Gradul negativ de oxidare are acei atomi care au luat electroni de la alți atomi sau la care sunt mutate perechi de electroni comune, adică atomi ai mai multor elemente electronegative. Valoarea pozitivă a gradului de oxidare are acei atomi care dau electronii lor altor atomi sau din care sunt desenate perechi electronice comune, adică atomi ai unor elemente mai puțin electronegative. Gradul zero de oxidare are atomi în molecule de substanțe simple și atomi într-o stare liberă, de exemplu:
În compuși, starea totală de oxidare este întotdeauna zero.

valență
Valența atomului unui element chimic este determinată în primul rând de numărul de electroni neparticipați care iau parte la formarea unei legături chimice.
Sunt determinate posibilitățile de valență ale atomilor:
• numărul de electroni nepartiți (orbitali cu un singur electron);
• prezența orbitalilor liberi;
• prezența perechilor de electroni neparticipați.
În chimia organică, conceptul de "valență" înlocuiește conceptul de "grad de oxidare", cu care se obișnuiește să lucreze în chimia anorganică. Cu toate acestea, nu este același lucru. Valence nu are nici un semn și nu poate fi zero, în timp ce gradul de oxidare este în mod necesar caracterizat de un semn și poate avea o valoare egală cu zero.
Practic, valența este înțeleasă ca abilitatea atomilor de a forma un anumit număr de legături covalente. Dacă există electroni nepartiți în atomii și perechile de electroni nepereche, atunci acest atom poate forma legături covalente n + m cu alți atomi, adică valența sa va fi egală cu n + m. Când se estimează valența maximă, trebuie să se procedeze din configurația electronică a stării "excitate". De exemplu, valența maximă a atomului de beriliu, bor și azot este de 4.
- H, Na, Li, K, Rb, Cs - Gradul de oxidare I
- O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd - Gradul de oxidare II
- B, Al, Ga, In - Gradul de oxidare III
Folosind valențele, puteți formula o formulă compusă.
Formula chimică este o înregistrare condiționată a compoziției unei substanțe prin semne și indicatori chimici.
De exemplu: Formula H2-O a apei, unde H și O sunt semnele chimice ale elementelor, 2 este indicele, care arată numărul de atomi ai unui element dat care alcătuiesc molecula de apă.
Când numele substanțelor cu valență variabilă este indicat în mod necesar valența sa, care este plasată în paranteze. De exemplu, P2 05 - oxid de fosfor (V)
I. Gradul de oxidare a atomilor și a atomilor liberi în moleculele substanțelor simple este zero - Na0, P40, O2O
II. Într-o chestiune complexă, suma algebrică a tuturor atomilor, ținând cont de indicii lor, este zero = 0. Și în ionul complex al încărcăturii sale.
De exemplu, să analizăm mai mulți compuși și să aflăm valența clorului:
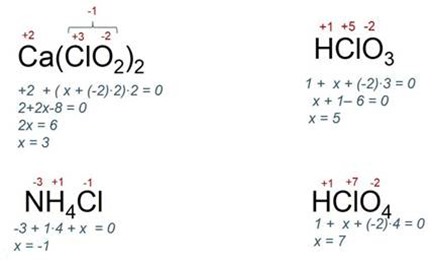

Materiale de referință pentru testare:


Articole similare
Trimiteți-le prietenilor: