Masa molară a substanței ne-volatile dizolvate - ne-electrolitic este determinată prin măsurarea punctului de fierbere al solventului sau scăderii punctului său de congelare atunci când conține o substanță dizolvată.
Din diagrama P-T a solventului pur și o soluție de (ris.225) că presiunea vaporilor saturați de solvent care conține solut (curba TC) este întotdeauna mai puțin legea Raoult) decât presiunea vaporilor saturați de solvent pur (curba Tm-B) și care determină o temperatură de reducere zamezaniya a solventului, atunci când acesta conține un solut (# 916; Tm)
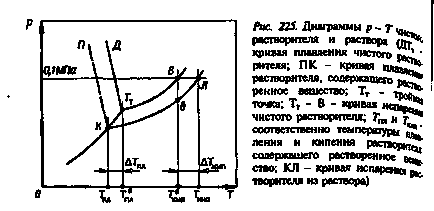
În schimb, punctul de fierbere al soluției T este mai mare decât cel al solventului pur pentru aceeași presiune externă.
În această diagramă, T0Kn este punctul de fierbere și T0 este temperatura de topire a solventului pur (vezi figura 87).
Raul Francois Marie (1830-1901) - fizician francez, a studiat chimia soluțiilor, a introdus în 1885 termenul "crioscopie".
Este clar că cu cât mai multă materie este în soluție, cu atât va fi localizată curba CR în comparație cu curba de evaporare a p-A pur
Pentru soluții foarte diluate, care diferă foarte puțin de proprietăți de cele ideale, dependența Tm din concentrația de substanță dizolvată Tm este determinată de ecuație
unde TLL - scăderea temperaturii de congelare a solventului; Mp este masa molară a solventului; R este constanta gazului universal, egală cu 8,314 JDmol • K); Т = Т ° πl - temperatura de topire a solventului pur
K; cm (B) - molitatea substanței dizolvate B, mol / kg;
H schimbarea entalpiei la topirea cristalelor de solvent pur kJ / mol; Кт - constantă crioscopică, kg • K / mol.
caracterizează numai solventul și nu depinde de natura substanței dizolvate.
Dacă proba de substanță B, dizolvată în 1000 g de solvent, este egală cu mV, iar masa molară a substanței B este Mg / mol, atunci
Prin urmare, rezultă că, prin măsurarea valorii # 916; Pentru o soluție diluată de substanță B într-un solvent selectat cu o valoare Km cunoscută, se poate calcula și masa molară Mc a substanței B.
Metoda de determinare a masei moleculare a unei substanțe dizolvate a substanței ne-volatile-ne-electrolitice prin scăderea temperaturii de congelare a solventului este numită crioscopie.
Prin metoda crioscopică, valoarea Mg poate fi determinată numai dacă moleculele substanței dizolvate nu sunt asociate într-un solvent dat și nu suferă asociere în soluție și concentrația substanței este suficient de mică.
Practic, această metodă este utilizată pentru a determina valoarea substanțelor organice și a compușilor anorganici covalenți.
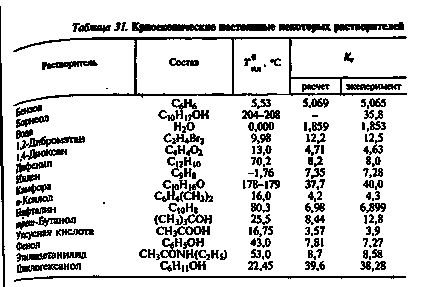
Dacă, odată cu scăderea temperaturii, cristalele de solvenți și dizolvați pur se scad simultan, atunci date fiabile privind masa molară a acestei substanțe nu pot fi obținute nici măcar pentru o soluție foarte diluată. În tabel. 31 prezintă valorile Rm pentru solvenții cei mai frecvent utilizați.
(Figura 226. Dispozitive pentru determinarea masei moleculare a materiei: Beckmann
Înainte de efectuarea experimentului, se recomandă verificarea valorii Kt pe orice substanță pură cunoscută, deoarece nu este întotdeauna posibilă garantarea purității solventului disponibil.
sens Tm este determinat într-un instrument Beckmann (figura 226, a). Se compune dintr-o sticlă largă 5 cu un amestec de răcire, care este agitată manual de un agitator 8. Temperatura amestecului de răcire trebuie să fie cu 3 până la 5 ° C sub temperatura de topire a solventului pur. Pentru a controla temperatura în sticla 5, este introdus un termometru convențional 4. Nivelul amestecului de răcire lichid trebuie să fie mai mare decât nivelul de soluție din tubul 7, care este plasat într-un tub mai larg 6, astfel încât distanța dintre pereții săi să fie de 5 mm. Tubul interior 7, în care are loc de fapt punctul de îngheț al solventului, este înconjurat de un strat de aer. Acest lucru asigură un curs lent și uniform de scădere a temperaturii soluției de testat.
Termometrul Beckmann 1 este setat înainte de experiment la temperatura dorită (vezi figura 89). În tubul interior 7 al dispozitivului colectat, o anumită cantitate de solvent este turnată prin tubul 3, așteptând un timp pentru a stabili o rată uniformă de răcire.
Când solventul este supracoheat cu 0,2-0,3 ° C sub punctul de topire, acesta este cristalizat prin agitare manuală cu un agitator 2.
După debutul precipitării cristalelor, solventul este încălzit până la punctul de topire, așa cum se vede din creșterea coloanei în capilarul termometrului Beckmann. Temperatura înghețării solventului este considerată a fi temperatura stabilită după atingerea echilibrului dintre solvent și cristalele sale.
În graficul de temperatură - timp, punctul de topire al Tm ar trebui să fie o zonă orizontală. Temperatura este măsurată cu până la 0,001 ° C Luând după operanzi tubul 7, solvent încălzit la 1 - 2 ° C peste temperatura de topire și apoi puneți-l într-o unitate de Beckman pentru remăsurare 7. Punct de topire solvent în ultimele experimente nu trebuie să difere cu mai mult de 0.002-0.003 o C.
Pentru a determina punctul de topire al solventului în prezența substanței dizolvate B, procedați după cum urmează. În tubul uscat 7 se toarnă cantitatea de solvent cântărită la precizia de 0,01 g (aproximativ 15-20 g) și se adaugă o probă exactă de 0,1-0,2 g de substanță, a cărei masă molară este determinată.
Proba este introdusă sub formă de pulbere fină într-un tub de testare îngust care trece prin tubul lateral 3 al tubului 7 astfel încât pulberea poate fi turnată direct în lichid și nu pe pereții tubului. Tubul de probă cu pulbere este cântărit înainte și după introducerea în dispozitiv.
Prin agitarea manuală cu un agitator 2, se realizează o dizolvare completă a probei și apoi se procedează ca și cu un solvent pur. Tubul 7 este subcoherat cu 0,2-0,5 ° C, iar apoi cu agitare 2, se eliberează cristalele de solvent. Amestecarea soluției cu un agitator 2 ar trebui să fie suficientă numai pentru a menține o temperatură uniformă.
La determinarea temperaturii, trebuie să atingeți ușor degetul pe termometru pentru a preveni întârzierea mișcării mercurului în capilar.
Temperatura după debutul cristalizării crește rapid, dar nu rămâne constantă și curând începe să scadă datorită faptului că soluția este concentrată deoarece înghețarea solventului. Rețineți că este necesară cea mai mare valoare a Tm. Diferența dintre punctele de topire ale unui solvent pur și o soluție de Tm este scăderea punctului de congelare al solventului # 916; 7pl, care este necesar pentru calcularea valorii Mg din ecuația (9.15).
Determinarea valorii lui Tm pentru soluție se efectuează de mai multe ori cu aceeași soluție, luându-se un tub pentru topirea cristalelor solventului în fiecare operație. Apoi, se măsoară Tm la diferite concentrații obținute prin adăugarea substanței în soluția de testat.
Metoda crioscopică este una dintre metodele cele mai convenabile pentru determinarea masei moleculare a unei substanțe.
Precizia metodei este în medie de 3%. Pentru a reduce eroarea datorată deviației soluțiilor din starea ideală, soluțiile foarte diluate de substanță B sunt utilizate în solvenți având o valoare constanta crioscopică mare (camfor, ciclohexanol) (vezi tabelul 31).
În locul metodei lui Beckmann se poate folosi și metoda caliară de determinare a valorii Tm.
Metoda Rast este de asemenea utilizată în același scop, pe baza solubilității ridicate a unor compuși organici în camfor și a valorii mari a Rm, ceea ce face posibilă determinarea valorii Mg pentru cantități mici de substanță (sub 1 mg).
Constanta crioscopică a camforului rămâne neschimbată numai dacă concentrația substanței dizolvate în ea nu este mai mică de 0,2 mol / l. În soluțiile mai diluate, valoarea Km este mai mare.
În metodele de creștere un tub subțire capilar cu pereți 3 (. Figura 226 b, imaginea este mărită), o lungime de aproximativ 40 mm, cu un diametru interior 2 - 3 mm a fost sigilat, pe de o parte, la partea de jos a tubului capilar nu se formează picăturile de sticlă groase. Capilarul este cântărit pe microîntreprinderi. după care substanța de testat se administrează prin intermediul a două laturi libere cu un capilar mai îngust 2. În acest scop, este imersat în substanța și apoi ștergeți cu grijă exteriorul particulelor aderente și deplasate ușor în capilar sigilate 3. Folosind o fibră de sticlă / ejectat materialul utilizat pe fund acest capilar. Dacă este necesar, operația se repetă atâta timp cât capilar nu va fi 0.2-1.0 mg de material. După cântărire, în același mod contribuie la aproximativ 2 - 10 mg de puritate 5 camfor, încercând capilar 2 cu camfor nu atinge deja introdusă substanța 6. cântărește din nou tubul capilar umplut și condensat la locul gâtuirea 4, trăgând capătul fuzionată cu o lungime filament subțire de 40 - 50 mm.
Capilarea topită 3 cu substanța 6 și camforul 5 este imersată în baia 9 cu ulei de silicon. încălzit la 180 ° C. Apoi rotiți firele 7 cu degetele până când amestecul se topește complet.
După aceea, capilarul se răcește, se scoate din baie timp de un timp și se scufundă din nou în el, reglând încălzirea băii la o viteză de maximum 1 deg / min, folosind un termometru 8 și un termostat 10.
În stare topită, camforul pur și amestecul său cu substanța de testat sunt lichide incolore, care se topesc rapid atunci când sunt congelate. În apropierea temperaturii
Articole similare
Trimiteți-le prietenilor: