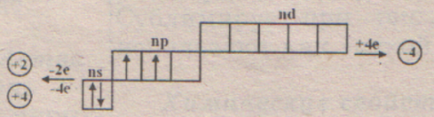
Pe stratul exterior 4 al electronului, stratul nu este completat, dar este umplut pe jumătate. Raza atomului de siliciu este mai mare decât cea a carbonului, acești electroni de valență sunt mai departe de nucleu decât de atomul de carbon => EO este scăzută; siliciul este un material nemetalic, dar atipic. În starea necondiționată, are doi electroni nepartimi, dar valența II de siliciu nu se manifestă în compuși. Prezența unei p-orbite libere face posibila trecerea S-electronului la el și apariția a patru epa- neparate. și => valența sa caracteristică - (IV). Posibile s.o. -4, se manifestă în compuși cu metale - silicide. Dar este formal. În realitate, compoziția multora dintre ele este variabilă și nu corespunde cu gradele obișnuite de oxidare. În programul școlar, silicidele nu sunt studiate. În toți compușii cu nemetalici, siliciul prezintă o stare de oxidare de +4. Cel mai simplu LAN - silan SiN4. este foarte instabilă. A
aici este oxid de SiO2 și toate sărurile de acid silicic - dimpotrivă, compuși foarte puternici.
Distribuția în natură: siliciul este de aproximativ 28% din masa crustă a pământului, adică asupra distribuției pe Pământ este al doilea doar oxigenului. Apare numai sub formă de diferiți compuși de oxigen - oxid și silicați. Crusta Pământului este formată din mai mult de jumătate dintre acești compuși. Acest lucru se explică prin capacitatea atomilor de siliciu de a forma legături deosebit de puternice cu oxigenul.
8. O substanță simplă. Pentru siliciu, alotropia este posibilă ca și în cazul carbonului, dar o modificare grafit (amorfă) (pulbere brună) este extrem de instabilă atunci când nu.
Diamant ca modificarea siliciului. cristal zăbrele - nucleare, toate cele patru legături sunt egale și sunt direcționate către nodurile tetraedru. Cristalele fine sunt gri închis cu luciu metalic. În natură, nu se întâmplă. Cristalele sunt refractare (1428 ° C), foarte dure, dar fragile; în apă nu se dizolvă. Siliciu cristalin - semiconductor, creșterile sale de conductivitate semnificativ asupra iluminării sau încălzire. conductivitatea este foarte dependentă de prezența anumitor impurități (de exemplu, impurități P da p-Si, și adăugarea B da p-Si. Siliciul este utilizat pe scară largă ca un semiconductor în microelectronică.

Ca oxidant, siliciul interacționează cu metalele:
Si + Ca → Ca2Si (silicid de calciu), la o temperatură ridicată
Ca agent reducător, siliciul reacționează cu oxigenul și alte nemetale active, cu oxizi, când este încălzit. Aceste reacții se desfășoară mult mai ușor, adică proprietățile de reducere pentru aceasta sunt mai caracteristice decât cele oxidante. De exemplu:
2) Si + C → SiC (carbură de siliciu -, cristale foarte dure transparente, cu un indice de refracție ridicat și este rezistent chimic, ca un diamant sau un singur oxid de cristal de aluminiu produs din ea șmirghel și cercuri, plăci pentru pardoseli, garnituri de furnale).
Compușii de siliciu cu hidrogen nu pot fi obținuți prin interacțiunea directă a substanțelor simple. Numele lor comun este silanele. Ele sunt foarte volatile, au un miros foarte neplăcut, se descompun cu ușurință, se autoinfectează în aer.
Noțiuni de bază. Nisipul de cuarț la siliciu la temperatură înaltă este recuperat de metale active sau de cocs. Dar un astfel de siliciu nu conduce un curent electric, pentru că conține impurități de 5-3%. Pentru nevoile electronicii radio, siliciul obținut este purificat prin metode speciale (topirea zonei).
1. Cristalele simple de siliciu cu aditivi adecvați servesc la producerea de fotovoltaice (celule solare și așa mai departe ...), diode și tranzistoare (redresoare și amplificatoare în dispozitive electrice). 2. În metalurgie, siliciul este utilizat pentru "dezoxidarea" oțelurilor și conferindu-le o rezistență sporită la coroziune.
9. Compuși de siliciu cu o stare de oxidare negativă. Silicidele (compuși de siliciu cu metale active) sunt utilizate pentru a produce aliaje rezistent la căldură și rezistente la acizi, materiale semiconductoare la temperaturi ridicate.
10. Mult mai des, atât în natură, cât și în industrie avem de-a face cu compuși de oxigen de siliciu în care are o stare stabilă pozitivă de oxidare.
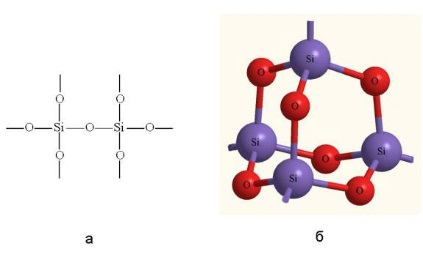


Un tip special de cuarț este sticla. formarea de minerale constând din silice cristalină și amorfă (SiO2) în rocile sedimentare. Adesea colorate cu oxizi de fier și mangan în diferite culori. Aceasta este o rocă opacă, foarte dură, care dă chips-uri ascuțite. Oamenii vechi au folosit-o pentru a obține foc și a face unelte.
Cristalele cu cristale au un indice de refracție ridicat de lumină, care trec prin raze ultraviolete, astfel încât acestea sunt utilizate în instrumente optice. Dintre acestea, bijuteriile sunt adesea făcute, imitând (cu succes) diamantele. Monocristalele cuarț au, de asemenea, un efect piezoelectric (adică efectul apariției polarizării unui dielectric sub acțiunea solicitărilor mecanice (și invers)). Acest efect este folosit în dispozitive acustice, piezoelectrice și mașini de spălat ...
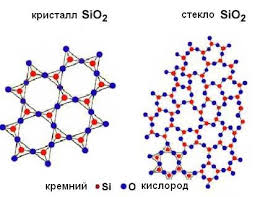
Oxidul de siliciu este inert chimic, nu se dizolvă în apă. Dar când este topit, reacționează cu alcalii, adică oxidul de siliciu este un oxid acid.
La temperaturi ridicate, se oxidează metalele active, adică pot prezenta proprietăți de oxidare. dar slab:
Mg + Si02 - MgO + Si
O proprietate chimică specială a oxidului de siliciu este capacitatea sa de a se dizolva în acid fluorhidric. Acest procedeu este utilizat pentru gravarea sticlei.
1). nisip în construcții;
2). nisip - în producția de sticlă;
3). nisip - in productia de ceramica (portelan, faianta, caramida);
4). nisip - în producția de ciment;
5). monocristale - în inginerie radio și electronică (amplificatoare și redresoare, înregistrarea și reproducere), aparate (dispozitive cu ultrasunete: mori coloidale, mașini de spălat, ultrasunete, etc.);
6). cuarț de sticlă - dispozitive optice și chimice
7). în formă amorfă - ca desicatori și adsorbanți.
Articole similare
Trimiteți-le prietenilor: