Pentru soluțiile diluate, legea lui Raoult este formulată după cum urmează: presiunea saturată a vaporilor de solvent deasupra soluției (P1) este proporțională cu fracția molară a solventului în soluție (N1):
unde P10 este presiunea de vapori saturată peste un solvent pur.
În soluții perfecte, fiecare componentă respectă legea lui Raoult, care în acest caz este scrisă după cum urmează:
unde
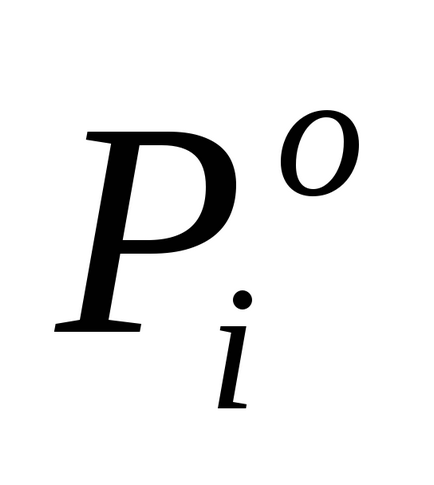
În acest caz, presiunea totală a vaporilor saturați deasupra soluției este egală cu suma presiunilor parțiale ale vaporilor saturați ai componentelor soluției:
Ecuația Raoult, ținând cont de disocierea solutului în soluții diluate, arată astfel:
unde i este coeficientul izotopic Van't Hoff, care arată de câte ori numărul de particule din soluție crește datorită disocierii și este legat de gradul de disociere α prin următoarea relație:
unde n este numărul de particule în care molecula disociază în soluție.
În funcție crește punctul de fierbere (ΔTkip = T -.. Tokip), și reduce temperatura de congelare a soluțiilor diluate de concentrațiile soluțiilor sunt exprimate prin următoarele ecuații pentru substanțele nedissotsiiruyuschih (T ΔTzam = Tozam.-.)
și ecuații pentru disocierea substanțelor
Unde este Tokip. Tozam. - punctul de fierbere și punctul de congelare al unui solvent pur;
m molitatea soluției;
Cabina. și Ccr. - Constantele erblioscopice și crioscopice ale solvenților, în funcție de natura lor și care nu depind de natura substanțelor dizolvate. Valorile acestor constante sunt date în literatura de specialitate.
Prin ridicarea punctului de fierbere (metoda de cercetare ebulioskopichesky - ebullioscope) sau coborârea punctului de congelare (metoda cryoscopic -krioskopiya Research) Soluțiile diluate se pot calcula concentrația de rastvorovm. coeficienții izotonici. gradul de disociere a solutei α și luând în considerare faptul că molalitatea este determinată de relația (2.5), masa molară M2:
Exemplul 2.2. Presiunea vaporilor de apă saturați deasupra soluției de materie nevolatilă în apă este mai mică cu 2% din presiunea de vapori față de apa pură. Determinați molitatea acestei soluții. Masa moleculară a apei M1 = 18 g / mol.
R e w n e
Se găsește fracția molară a soluției într-o soluție dată, pentru care folosim ecuația legii Raoul (2.7):
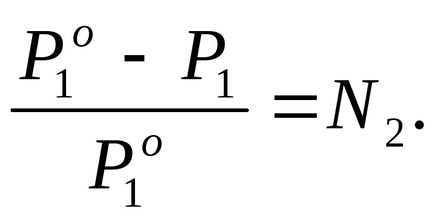
Prin condiția problemei P1 este cu 2% mai mică
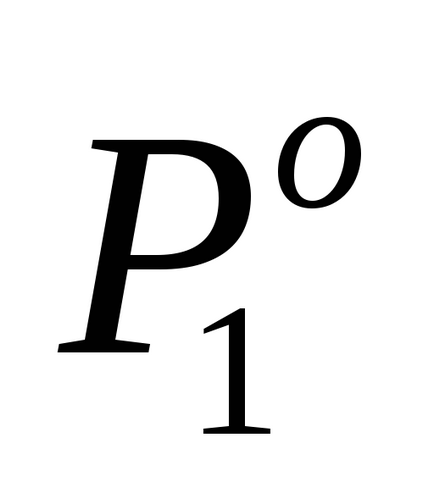
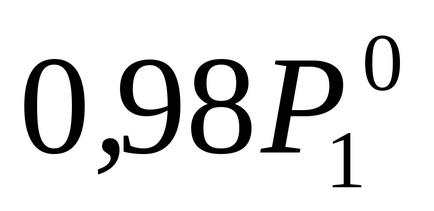
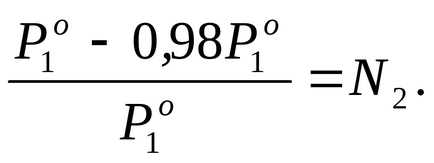
Pentru a determina molitatea lui m, se calculează numărul de moli solute2. într-o soluție pe 1000 g de apă. În acest caz, m = n2.
Cantitatea de moli de apă în 1000 g este:
În conformitate cu definiția (2.2), se scrie expresia pentru fracția molară a substanței dizolvate:
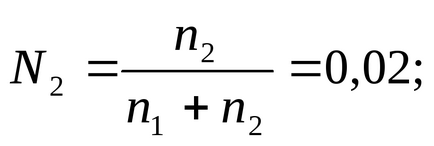
în care înlocuim valoarea lui n1. dar în loc de n2-m. și găsiți această valoare:
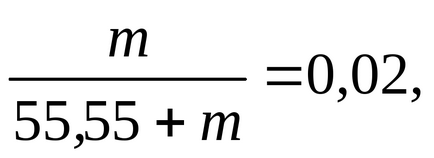
m = 1,134 mol / 1000 g apă.
EXEMPLUL 2.3. Se calculează presiunea totală de vapori saturată pe o soluție perfectă binară la o temperatură de 313 K, constând din 200 g dicloretan C2H4Cl2 (DCE) și 350 g benzen C6H6 (B). dacă presiunea saturată a vaporilor deasupra acestor substanțe pure la temperatura indicată este: RoDXE = 2.066 · 10 4 Pa și
Gasim numarul de moli de componente in solutie:
numărul total de moli de substanțe:
Se calculează fracțiile molare ale fiecărei componente în soluție:
Presiunea saturată a vaporilor peste soluția fiecărei componente se găsește din ecuația legii lui Raoult pentru soluții perfecte (2.7):
Presiunea totală se calculează prin ecuația (2.8):
EXEMPLUL 2.4. Se calculează punctul de îngheț (cristalizarea) soluției de sulf 1% S în fierul de fier. dacă temperatura de cristalizare a fierului pur este de 1813 K, iar Cr. = 101,5 K / mol. Masa molară a sulfului este de 32 g / mol.
Dacă această soluție conține 1% din substanța dizolvată, atunci 100 g din această soluție conține 1 g de sulf g2 și 99 g de fier g1. Calculăm molitatea soluției de sulf în fier, conform ecuației (2.5):
Calculam scăderea punctului de îngheț prin ecuația (2.12):
Punctul de îngheț al soluției de sulf în fier:
EXEMPLUL 2.5. Calculați cantitatea de C2H4 (OH) 2 etilenglicol care trebuie adăugată la 500 g de apă g1. pentru a reduce punctul de îngheț al soluției cu 3 grade. Constanta critica de apa Ccr. = 1,86 deg / mol. Masa molară a etilenglicolului M2 = 62 g / mol.
Găsim molonalitatea soluției prin ecuația (2.15):
Din formula (2.5) pentru calculul molalității:
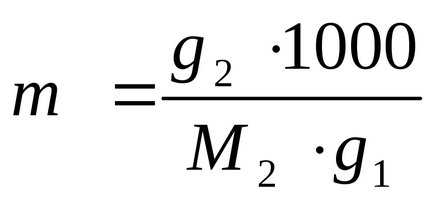
exprimă și calculează valoarea g2:
EXEMPLUL 2.6. Calculați masa molară a substanței în cazul în care temperatura de congelare a soluției conține 200 g de benzen g1 și 0,4 g de substanță de testat g2. la 0,17 K sub punctul de îngheț al benzenului. Constanta constanta de benzen. = 5, 16 K / mol.
Calculul se efectuează în conformitate cu formula (2.18) pentru crioscopie:
EXEMPLUL 2.7. Se calculează gradul aparent de disociere a sării de BaCl2 într-o soluție apoasă de 3,2% dacă punctul de fierbere al soluției apoase este de 100,21 ° C. Masa molară a clorurii de bariu este de 208 g / mol. Constanta erblioscopica a apei. = 0,512 deg / mol.
Determinăm molalitatea soluției prin formula:
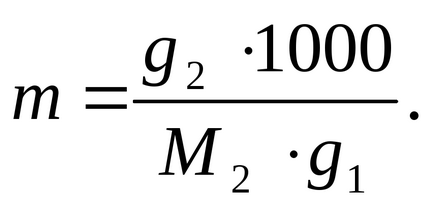
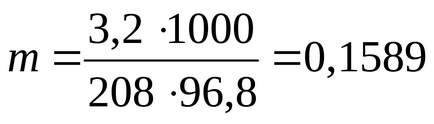
unde 100 ° C este punctul de fierbere al unui solvent pur (apă).
Gasim coeficientul izotonic din ecuatia (2.17):
.
Gradul de disociere α se găsește din relația (2.10):
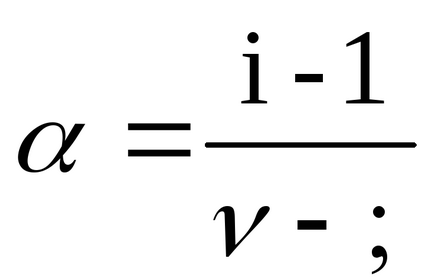
pentru BaCl2ν = 3, deoarece atunci când se disociază o moleculă din această sare, se formează trei ioni;
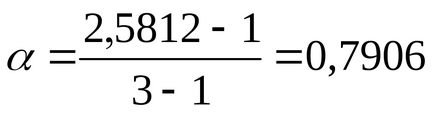
Gradul de disociere găsit pentru un electrolit puternic este evident, iar disocierea adevărată este aproape de 1 conform teoriei lui Arrhenius.
Articole similare
Trimiteți-le prietenilor: