În 1903, W. Henry a concluzionat că etapa necesară a catalizei enzimatice este legătura dintre enzimă și substrat, rezultând formarea unui complex enzimatic-substrat. Dezvoltarea acestei idei a dus la crearea unei teorii generale a acțiunii enzimelor; în special o mare contribuție la aceasta în 1913. realizate de L. Michaelis și M. Menten. Potrivit ipotezei lor, procesul de cataliză enzimatică poate fi împărțit în trei etape:
1) difuzia substratului în enzimă și legarea sa sterică la centrul activ al enzimei, adică formarea complexului enzimatic-substrat (ES);
2) transformarea complexului primar în unul sau mai multe complexe enzimă-substrat activate (ES *, ES ** ...);
3) separarea produselor (P) ale reacției de la centrul activ și difuzia acestuia în mediul înconjurător.
Prima etapă este de obicei scurtă și depinde de concentrația substratului în mediu, precum și de difuzia sa în centrul activ al enzimei. Complexul este format aproape instantaneu. Substratul se alătură centrului activ în mai multe puncte, formând complexe chelate (clawlike). Conexiunea se realizează prin legături de diferite tipuri, în principal slabe (hidrogen, electrostatic, hidrofob, coordonare), legături covalente sunt rare. În această etapă, schimbarea energiei de activare este nesemnificativă, orientarea substratului și a centrului activ promovează convergența și reacția lor.
A doua etapă este cea mai lentă și limitează viteza întregii catalize ca întreg. Durata sa depinde de energia de activare a unei reacții chimice date. În această etapă, legăturile substratului sunt slăbite, ruptura lor sau formarea de noi legături ca urmare a interacțiunii cu grupările active ale enzimei. Datorită formării complexelor de tranziție activate, energia de activare a reacției este redusă.
A treia etapă este aproape instantanee. Se determină prin rata de difuzie a produselor de reacție în mediu.
Natura forțelor care stabilizează diferitele stări conformaționale ale complexului enzimă-substrat
Interacțiunile moleculare reversibile în sistemele biologice sunt mediate de forțe de trei tipuri. Plierea macromoleculelor într-o structură complexă, legarea substratului la enzimă, interacțiunea celulă-celulă, adică toate interacțiunile moleculare în sistemele biologice sunt realizate prin formarea de legături de hidrogen, iar legăturile cauzate de interacțiuni electrostatice și van der Waals. Aceste trei tipuri principale de legături necovalente diferă în funcție de geometrie, energie și specificitate. În plus, deși ele sunt întotdeauna influențate de prezența apei, acest efect se manifestă în moduri diferite. Să analizăm în detaliu fiecare dintre aceste tipuri de conexiuni de bază.
Interacțiuni electrostatice
Un grup de substrat încărcat poate reacționa cu un grup de enzime care poartă o încărcătură opusă. Rezistența acestei interacțiuni electrostatice este determinată de legea lui Coulomb:
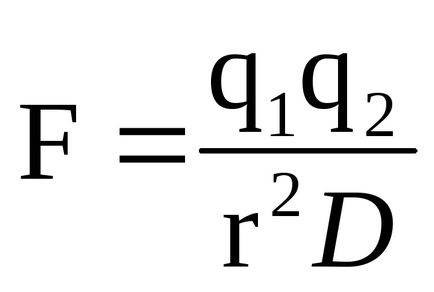
unde q1 și q2 sunt sarcinile grupurilor corespunzătoare, r este distanța dintre ele, iar D este constanta dielectrică a mediului. Interacțiunea electrostatică se manifestă cel mai puternic într-un vid (unde D = 1) și cel mai slab într-un mediu, cum ar fi apa (unde D = 80).
Un exemplu de interacțiune electrostatică este legarea glicil-L-tirozinei la carboxipeptidaza A, o enzimă proteolitică care scindează resturile de aminoacid C-terminale. Gruparea carboxil terminală încărcată negativ a substratului dipeptidic interacționează cu gruparea guanidină încărcată pozitiv a restului de arginină asupra enzimei. Distanța dintre aceste două grupuri încărcate opus este de 0,28 nm:
Acest tip de interacțiune se numește și legare ionică. sare de lipire. punte de sare sau pereche de ioni. Toți acești termeni au același înțeles: interacțiunea electrostatică între grupurile încărcate opuse. Între substratul încărcat negativ și lanțul lateral încărcat pozitiv al reziduului de lizină sau arginină, pot apărea interacțiuni electrostatice. Dacă pK grupării imidazol de rest de histidină sau gruparea amino terminală a lanțului polipeptidic asigură sarcina lor pozitivă la pH-ul mediului, acestea pot funcționa și ca potențial de legare situsuri de vanija substrat încărcat negativ. În cazul în care substratul are o sarcină pozitivă, situsuri potențiale de legare sunt încărcate negativ grupările carboxil ale aspartat și glutamat, și gruparea carboxil terminală a lanțului polipeptidic.
Articole similare
Trimiteți-le prietenilor: