Structura primară a proteinelor este un lanț polipeptidic liniar de aminoacizi legați împreună prin legături peptidice. Structura primară este cel mai simplu nivel al organizării structurale a moleculei de proteine. Stabilitate ridicată este dată de legăturile peptidice covalente între Grupa amino a unui aminoacid și # 945; -carboxil al unui alt aminoacid
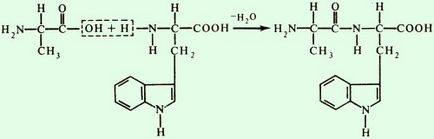
Dacă gruparea imino a prolinei sau a hidroxiprolinei este implicată în formarea unei legături peptidice, atunci ea are o formă diferită
În formarea legăturilor peptidice în celule, gruparea carboxilică a unui aminoacid este mai întâi activată și apoi se combină cu gruparea amino a celuilalt. În mod similar, se efectuează o sinteză de laborator a polipeptidelor.
Legătura peptidică este un fragment repetat al lanțului polipeptidic. Are o serie de caracteristici care afectează nu numai forma structurii primare, ci și nivelurile superioare de organizare a lanțului polipeptidic:
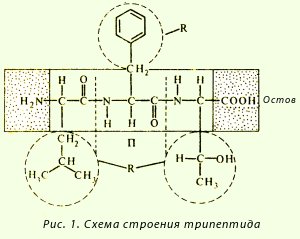
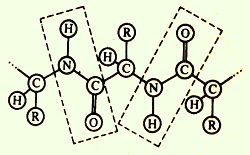
· Coplanaritatea - toți atomii care intră în grupul de peptide se află în același plan;
Abilitatea de a exista în două forme rezonante (formă ceto- sau enol);
· Trans-poziția substituenților în legătură cu legătura C-N;
Abilitatea de a forma legături de hidrogen, fiecare din grupurile peptidice poate forma două legături de hidrogen cu alte grupuri, inclusiv grupuri peptidice.
Excepțiile sunt grupări peptidice cu participarea grupării amino a prolinei sau a hidroxiprolinei. Ele sunt capabile să formeze doar o legătură hidrogen (vezi mai sus). Aceasta afectează formarea structurii secundare a proteinei. Lanțul polipeptidic la locul unde este localizat prolină sau hidroxiprolină este ușor îndoit, deoarece nu este reținut, ca de obicei, printr-o a doua legătură de hidrogen.
Schema de formare a tripeptidelor:
Nivelurile organizării spațiale a proteinelor: structura secundară a proteinelor: conceptul de # 945; - băi și Stratul acoperit. Structura terțiară a proteinelor: conceptul proteinei native și denaturarea proteinelor. Structura cuaternară a proteinelor pe baza exemplului structurii hemoglobinei.
Structura secundară a proteinei. Prin structura secundară a unei proteine se înțelege o metodă de stivuire a unui lanț polipeptidic într-o structură ordonată. Conform configurației, se disting următoarele elemente ale structurii secundare: # 945; - helix și # 946; - Stratul de spumă.
Model de construcție # 945; - helixul, care ia în considerare toate proprietățile legăturii peptidice, a fost dezvoltat de L. Pauling și R. Corey (1949-1951).
Figura 3a prezintă circuitul # 945; Helix, oferind o idee despre principalele sale parametri. Lanțul polipeptid se pliază în # 945; - helix în așa fel încât bobinele helixului să fie regulate, prin urmare configurația spirală are simetria șurubului (figura 3, b). La fiecare tură # 945; - helixul reprezintă 3,6 reziduuri de aminoacizi. Distanța dintre răsuciri sau treapta helixului este de 0,54 nm, unghiul de întoarcere este de 26 °. Formarea și întreținerea # 945; - configurația elicoidală apare datorită legăturilor de hidrogen formate între grupările peptidice ale fiecărui rest de aminoacid n-lea și (n + 3). Deși energia legăturilor de hidrogen este mică, un număr mare dintre acestea conduce la un efect energetic semnificativ, care rezultă în # 945; Configurația spirală este destul de stabilă. Radicalii laterali ai resturilor de aminoacizi nu sunt implicați în menținerea # 945; configurația elicoidală, prin urmare, toate reziduurile de aminoacizi din # 945; Bobinele sunt echivalente.
În proteinele naturale există doar răsucite în dreapta # 945; - helixul.
Stratul pliabil este cel de-al doilea element al structurii secundare. spre deosebire de # 945; - helix # 946; - Stratul pliat are o formă mai liniară decât o tijă (Figura 4). Structura liniară este reținută datorită apariției legăturilor de hidrogen între grupările peptidice care sunt localizate la diferite situsuri ale lanțului polipeptidic. Aceste regiuni se dovedesc a fi apropiate de distanța dintre legăturile de hidrogen între grupările C = 0 și HN (0,272 nm).
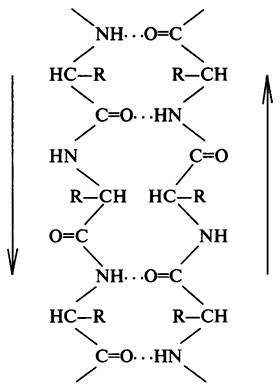
Fig. 4. Reprezentarea schematică # 946; - strat închis (indică săgețile
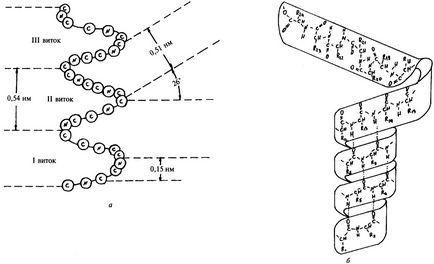
Fig. 3. Schema (a) și modelul (b) # 945; - helix
Structura secundară a proteinei este determinată de cea primară. Reziduurile de aminoacid sunt capabile să formeze legături de hidrogen în grade diferite, ceea ce afectează formarea # 945; - helix sau # 946; strat de tip. Aminoacizii care formează spirala includ alanina, acidul glutamic, glutamina, leucina, lizina, metionina și histidina. Dacă fragmentul proteic constă în principal din resturile de aminoacizi enumerate mai sus, atunci a # 945; - helix. Valina, izoleucina, treonina, tirozina și fenilalanina contribuie la formarea de # 946; straturi ale lanțului polipeptidic. Structurile neordonate apar pe situsurile lanțului polipeptidic în care sunt concentrate reziduurile de aminoacizi cum ar fi glicina, serul, acidul aspartic, asparagina, prolină.
În multe proteine simultan există # 945; - helix și # 946; -fibers. Proporția configurației elicoidale pentru diferite proteine este diferită. Astfel, paramyosinul proteic muscular este practic de 100% elicoidal; o proporție mare a configurației elicoidale în mioglobină și hemoglobină (75%). În contrast, în tripsină și ribonuclează, o porțiune semnificativă din lanțul polipeptidic se potrivește în stratul stratificat # 946; -Structura. Proteinele țesuturilor de sprijin - cheratina (proteine de păr), colagenul (proteinele și tendoanele din piele) - au # 946; -configurarea lanțurilor de polipeptide.
Structura terțiară a proteinei. Structura terțiară a proteinei este o modalitate de a stabili un lanț polipeptidic în spațiu. Pentru ca o proteină să dobândească proprietățile sale funcționale inerente, lanțul polipeptidic trebuie să se îndoaie într-un anumit mod în spațiu, formând o structură funcțională activă. Această structură se numește nativă. În ciuda numărului mare de structuri spațiale posibile teoretic pentru un lanț polipeptidic unic, plierea proteinei duce la formarea unei singure configurații native.
Structura terțiară a proteinei de interacțiune se stabilizează între radicalii laterali ai resturilor de aminoacizi din diferite părți ale lanțului polipeptidic. Aceste interacțiuni pot fi împărțite în puternice și slabe.
Interacțiunile puternice includ legături covalente între atomii de sulf ai resturilor de cisteină care sunt localizate în diferite părți ale lanțului polipeptidic. În caz contrar, astfel de legături se numesc punți disulfidice; formarea unei punți disulfidice poate fi prezentată după cum urmează:
În plus față de legăturile covalente, structura terțiară a moleculei proteice este susținută de interacțiuni slabe, care, la rândul lor, sunt împărțite în cele polar și nepolar.
Interacțiunile poliare cuprind legături ionice și hidrogen. Interacțiunile ionice se formează la contactul grupurilor încărcate pozitiv cu radicali laterali ai lizinei, argininei, histidinei și a unui grup COOH încărcat negativ de acizi aspartici și glutamici. Legăturile de hidrogen apar între grupările funcționale ale radicalilor laterali ai resturilor de aminoacizi.
Interacțiunile non-polar sau van der Waals între radicalii de hidrocarburi ai resturilor de aminoacizi contribuie la formarea unui nucleu hidrofob (picături grase) în globulele de proteine, deoarece Radicalii de hidrocarburi tind să evite contactul cu apa. Cu cât este mai mare proteina din aminoacizii nonpolari, cu atât mai mare este rolul legăturilor van der Waals în formarea structurii sale terțiare.
Numeroasele legături dintre radicalii laterali ai resturilor de aminoacizi determină configurația spațială a moleculei de proteină (Figura 5).
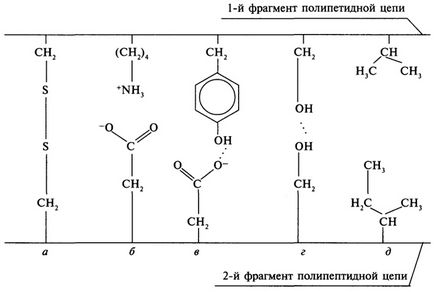
Fig. 5. Tipuri de legături care susțin structura terțiară a proteinei:
a - punte disulfidică; b - legătură ionică; c, d - legături de hidrogen;
d - van der Waals
Structura terțiară a unei anumite proteine este unică, ca și structura sa primară. Numai o ambalare corectă a proteinelor spațiale o face activă. Diferitele tulburări ale structurii terțiare conduc la o schimbare a proprietăților proteinei și la pierderea activității biologice.
Structura cuaternară a proteinelor. Proteinele cu o masă moleculară mai mare de 100 kDa 1 constau de obicei din mai multe lanțuri polipeptidice cu o greutate moleculară relativ mică. O structură constând dintr-un anumit număr de lanțuri polipeptidice care ocupă o poziție strict fixă relativ una față de cealaltă, ca rezultat al căror proteină are una sau cealaltă activitate, se numește structura cuaternară a proteinei. O proteină care are o structură cuaternară se numește epimoleculară sau multiplicator. și lanțurile sale polipeptidice constituente sunt respectiv subunități sau protomeri. O caracteristică caracteristică a proteinelor cu structură cuaternară este aceea că o singură subunitate nu posedă activitate biologică.
Stabilizarea structurii cuaternare a proteinei are loc datorită interacțiunilor polare dintre radicalii laterali ai resturilor de aminoacizi localizați pe suprafața subunităților. Astfel de interacțiuni țin ferm subunitățile sub forma unui complex organizat. Locurile de subunități, pe care se produc interacțiuni, se numesc plăcuțe de contact.
Un exemplu clasic de proteină care are o structură cuaternară este hemoglobina. Moleculele de hemoglobină cu o greutate moleculară de 68 000 Da constau din patru subunități de două tipuri diferite - # 945; și # 946; / # 945; Subunitatea constă din 141 reziduuri de aminoacizi, a # 946; - din 146. Structura terțiară # 945; - și # 946; subunitățile sunt similare, ca și greutatea lor moleculară (17.000 Da). Fiecare subunitate conține un grup protetic - heme. Deoarece hema este prezentă în alte proteine (citocromi, mioglobină), care vor fi studiate în continuare, cel puțin o scurtă discuție despre structura subiectului (Figura 6). Gruparea heme este un sistem ciclic complex, coplanar, format dintr-un atom central care formează legături de coordonare cu patru resturi de pirol conectate prin punți metanice (= CH-). În hemoglobină, fierul este, de obicei, în starea de oxidare (2+).
Patru subunități - două # 945; și două # 946; - să se unească într-o singură structură în așa fel încât să # 945; Subunitățile sunt contactate numai cu # 946; subunități și invers (figura 7).
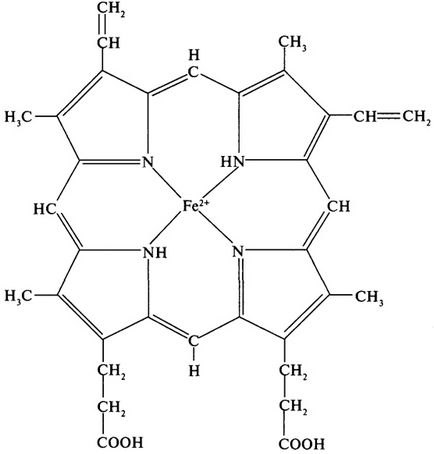
Fig. 6. Structura hemoglobinei hemene
Fig. 7. Reprezentarea schematică a structurii cuaternare a hemoglobinei:
Fe - hemoglobină
Așa cum se poate vedea din figura 7, o moleculă de hemoglobină este capabilă să transporte 4 molecule de oxigen. Atât legarea, cât și eliberarea oxigenului sunt însoțite de modificări conformaționale în structură # 945; - și # 946; subunitățile de hemoglobină și aranjamentul reciproc în epimolecul. Acest fapt indică faptul că structura cuaternară a proteinei nu este absolut rigidă.
Trimiteți-le prietenilor: