Se calculează punctul de fierbere al unei soluții 5% de naftalen C10H8 în benzen. Punctul de fierbere al benzenului este de 80,2 ° C. Constanta ebulliografică este de 2,57 ° C.
Conform legii lui Raoult, o creștere a punctului de fierbere al soluției în comparație cu punctul de fierbere al solventului este exprimată prin ecuația:
ΔT este schimbarea punctului de fierbere al soluției, ºС
K este constanta ebullioscopică, ºС;
m este masa solutului, g;
m1 este masa solventului, g;
M este masa molară a substanței dizolvate, g
M C10H8 = 12 * 10 + 1 * 8 = 128g
Răspuns: Punctul de fierbere al unei soluții 5% de naftalină C10H8 în benzen este de 81,25 ° C.
Subiect: Hidroliza sărurilor.
Gidroliz- o interacțiune chimică a ionilor de sare dizolvate din apa, rezultând produse formarea slabodissotsiiruyuschih (molecule de acizi slabi sau baze, anioni de săruri acide sau bazice ale cationilor) și însoțite izmeneniempHsredy.
1.Na3PO4 este o sare a unei baze puternice (alcaline) de NaOH și o medie a acidului (fosforic) H3PO4. Hidroliza sarii are loc intr-un mod anionic, deoarece cationul Na +, legând la anionul hidroxil OHH, formează un puternic electrolitic NaOH, care disociază în ioni.
Acidul tribazic fosforic formează trei tipuri de săruri:
NaH2PO4-fosfat primar Na, foarte solubil
Na2HP04 - fosfat secundar Na, practic insolubil
Na3PO4-fosfat terțiar Na, practic insolubil.
Din aceasta este clar că în hidroliza Na3P04, adică reacția, mergând la formarea unei săruri slab disociabile (puțin solubile), se va forma fosfat de sodiu secundar Na2HP04.
Na3P04 + H20O2Na2HP04 + NaOH
NaH2P04 + H20 = H3P04 + NaOH
De obicei, reacția se desfășoară în prima etapă, apoi se acumulează ioni de hidroxil OH și nu dă reacție până la sfârșit.
Deoarece se formează o sare acidă și o bază tare (alcalii), reacția soluției va fi alcalină, adică pH> 7.
2. Sarea K2S, sulfura de potasiu este sarea unei baze puternice și acidul fluorhidric slab H2S Hidroliza sarii va merge in doua etape, tk. hidrogen sulfurat este dibazic, anionic. Sarea K2S se disociază în dizolvarea K + și sulfură-anion S ² 2 în apă. Cationul K + nu poate lega anionul hidroxilic; formând astfel un puternic elektrolitKOH care disociază imediat în ioni și acid slab sulfurat anionS¯² se leagă cu gruparea hidroxil din compusul malodissotsiiruyuschee.
Hidroliza trece prin prima etapă cu formarea unei reacții puternic alcaline, pH> 7.
3. CuSO4, sulfatul de cupru este sarea unui acid puternic și a unei baze slabe multi-acizi. Cu (OH) 2. Hidroliza sarii va continua cu formarea de cationi ai sarii CuOH + bazice.
CuSO4 + H2O2 (CuOH) 2S04 + H2S04
În două etape, reacția nu se datorează ionilor de hidrogen în exces formați din acid sulfuric puternic. Mediul are o reacție acidă, pH<7.
Subiect: Reacții de reducere a oxidării.
Reacțiile sunt exprimate prin scheme
Compune ecuații electronice. Aranjați coeficienții în ecuațiile de reacție. Pentru fiecare reacție, se indică ce substanță este un oxidant, care este un agent de reducere; ce substanță este oxidată, ceea ce este recuperat.
Reacțiile însoțite de o schimbare a gradului de oxidare a atomilor care fac parte din substanțele care reacționează se numesc reacții redox. În același timp, o substanță este oxidată, cealaltă este recuperată, acest proces este interdependent.
Gradul de oxidare este înțeles ca sarcina condițională a unui atom, care se calculează pe presupunerea că molecula constă numai din ioni.
Gradul de oxidare este o sarcină condițională care ar dobândi atomul elementului dacă se presupune că a primit sau dat un anumit număr de electroni.
Oxidarea este procesul de recul a electronilor de către un atom, o moleculă sau un ion.
Recuperarea este procesul de atașare a electronilor de un atom, o moleculă sau un ion.
Electronul este un agent reducător, el este însuși oxidat,
Receptorul de electroni care primește electronul este refăcut.
1.Snachala în această schemă ecuațiile definesc gradul de oxidare a atomilor din partea stângă și dreaptă a ecuației, și apoi să analizeze modul de a schimba starea de oxidare a fiecărui atom participă la procesul redox, forma electronică ecuația și metoda de ecuații de bilanț electronice despărțire coeficienți.
H2S + Cl2 + H20 - H2S04 + HCI
Gradul de oxidare a sulfului în compusul H2S (-2) este scăzut,
în compusul H2SO4 (+6) -alt. Hidrogenul sulfurat este un agent reducător, este oxidat.
Gradul de oxidare a clorului în clor liber este (0) - intermediar, în acid clorhidric
(-1) este cel mai mic. Clorul este un oxidant, este regenerat.
Scrieți ecuațiile electronice:
Reducător S ²² -8e = proces de oxidare S + 6/8 К = 1
Agent de oxidare 2Cl ° + 2e = 2Cl1¹ procesul de reducere / 2 K = 4
Numărul total de electroni dat de agentul reducător-8 este dat de un mol de hidrogen sulfurat. Același număr de electroni ar trebui să ia un oxidant: 1 mol de clor are nevoie de 2 electroni, în conformitate cu legea multiplicității; 8 electroni vor lua 4 moli de clor. Am pus coeficientul 1 în fața moleculei H2S și coeficientul 4 în fața moleculei Cl2. Am plasat coeficienții rămași în concordanță cu acestea. Ecuația ia forma:
H2S + 4CI2 + 4H2O -> H2S04 + 8HCI
Deci, în reacția prezentată:
-Cl2 este un agent de oxidare, este el însuși redus; 4 molecule conținând 8 atomi de clor, ia 8 * 1 = 8 electroni.
dă 1 * 8 = 8 electroni.
2. Schema ecuației de reacție:
K2Cr2O7 + H2S + H2SO4 → S + Cr2 (SO4) 3 + K2S04 + H20
Furnizăm stări de oxidare
K2Cr2O7 + H2S + H2SO4 → S + Cr2 (SO4) 3 + K2S04 + H20
Atomul cromului modifică gradul de oxidare de la +6 la +3, adică necesită 3 electroni și este un oxidant.
Atomul de sulf din molecula de acid sulfuric nu modifică gradul de oxidare, deci nu participă la procesul de oxidare-reducere. Atomul de sulf, care face parte din molecula hidrogen sulfurat, modifică starea de oxidare de la (-2) la (0), adică emite electroni și este un agent reducător. Ecuațiile electronice au forma:
Reducător S ²² -8e = proces de oxidare S + 6/8
Oxidatorul Cr + 6 + 3e = procesul de recuperare Cr + 3/3
Având în vedere faptul că 2 molecule de Cr intră în molecula K2Cr2O7, numărul total de electroni acceptați de molecula K2Cr2O7 este de 6, ecuația electronică ia forma:
Reducător S ²² -8e = proces de oxidare S + 6/8
Agent de oxidare 2Cr + 6 + 6e = 2Cr + 3 proces de recuperare / 6
Cea mai mică multiplă pentru cifrele 8 și 6 este 24.
Coeficientul pentru atomii unei molecule care conține S ²2 este 24/8 = 3
Coeficientul pentru atomii unei molecule care conține Cr + 6 este egal cu 24/6 = 4
Am pus acești coeficienți și am selectat restul.
Ecuația de reacție are forma:
4K2Cr2O7 + 3H2S + 16H2SO4 → 3S + 4Cr2 (SO4) 3 + 4K2SO4 + 28H2O
Deci, în reacția prezentată:
da 3 * 8 = 24 de electroni.
Subiect: potențialul electrodului și forțele electromotoare.
Faceți schemele a două celule galvanice, la una dintre care cuprul ar fi un catod, iar în celălalt anod.
Scrieți pentru fiecare dintre aceste elemente ecuațiile electronice ale reacțiilor care au loc pe catod și pe anod.
Potențialul electrodului este un strat dublu electric caracterizat printr-un salt potențial care se formează la interfața metal-lichid.
Mecanismul apariției sale este: atunci când o placă metalică este imersată în apă, cationii metalici de pe suprafața ei sunt hidratați de moleculele polare de apă și trec într-un lichid. Electronii rămași în metal au o încărcătură negativă stratului de suprafață. Există o atracție electrostatică între cationii hidrați și suprafața metalului care a trecut în lichid. Sistemul stabilește un echilibru mobil:
Me + mH2Ol Me (H20)
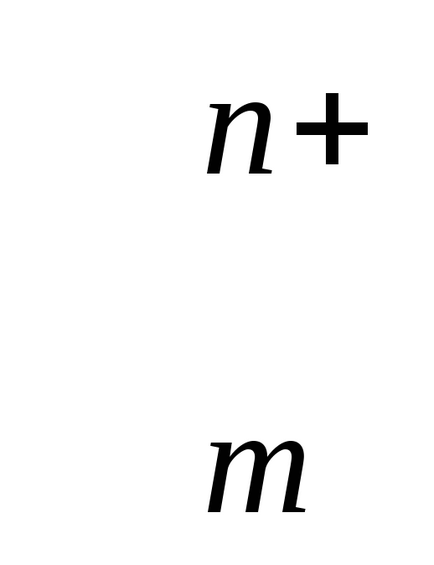
n este numărul de electroni care participă la proces.
potențial standard de electrod - este potențialul de electrod care apare atunci când metalul este cufundat într-o soluție de ioni proprii cu concentrația (sau activitatea) de 1 mol / l, măsurată prin comparație cu un electrod standard de hidrogen.
Potențialul unui electrod standard de hidrogen la 25 ° C este presupus în mod condiționat a fi egal cu zero (E ° = 0, ΔG ° = 0).
Dacă metalele sunt aranjate într-o serie pe măsură ce potențialul electrodului lor crește. obținem un număr de potențiale standard de electrod sau o serie de solicitări.
Cu cât este mai mică valoarea potențialului electrodului standard E °, cu atât sunt mai mari proprietățile de reducere pe care acest metal le posedă sub forma unei substanțe simple și capacitatea mai puțin oxidativă este expusă de ionii săi și invers.
Reamintim că pe anod:
procesul de recul a electronilor de către un atom, o moleculă sau un ion trece prin oxidare. Electronul este un agent reducător, el este însuși oxidat,
Există o restaurare, procesul de atașare a electronilor de un atom, o moleculă sau un ion.
Receptorul de electroni care primește electronul este refăcut.
Pentru soluție folosim datele unui număr de solicitări și regulile de mai sus.
Metalele având o valoare numerică mai mică E °, adică situate într-o serie de solicitări de mai sus cupru, vor prezenta proprietăți de reducere mari ca o substanță simplă, adică Me ° va servi ca un anod și va da electronii. În acest caz, cuprul va fi un catod.
Alegem orice metal, de exemplu bismut.
Prin metoda celor mai puțini multipli aranjăm coeficienții, ecuația ia forma:
2 Bi + 6e + 3Cu + 2 + 6e = 2Bi + 3 + 3Cu ° sau
2 Bi + 3Cu + 2 = 2Bi + 3 + 3Cu °
Acum ia în considerare opțiunea, când cuprul va servi ca anod. Alegem un metal situat sub cupru într-o serie de solicitări, de exemplu argint.
Cuprul (o substanță simplă), având o valoare numerică mai mică E °, va prezenta proprietăți de restaurare, adică da electroni si serveste ca un anod.
Ecuația totală a reacției
Сu ° - 2e + 2Ag + + 2e = Cu + 2 + 2Ag °
Compuneți ecuațiile electronice ale proceselor care apar pe electrozi de grafit în electroliza topiturilor și a soluțiilor apoase de NaCl și KOH.
Câte litri (nu) de gaz se vor elibera la anod în timpul electrolizei hidroxidului de potasiu, dacă se efectuează electroliza timp de 30 de minute la un curent de 0,5 A?
Într-o soluție sau o topire, cationii și anionii se mișcă haotic. Dacă electrozii neutri (grafit) sunt aruncați în acest mediu, este trecut un curent electric constant, atunci mișcarea cationilor și anionilor are mișcare direcționată în conformitate cu semnele lor.
Pe catod, cationii iau electroni, recuperează, anionii sunt emise de anioni, oxidând.
Astfel, electroliza se numește procesul de oxidare-reducere, care se realizează pe electrozi când curentul electric trece printr-o soluție topită sau electrolitică.
Procesele de electroliză a soluției și a topiturii diferă una de alta prin faptul că electroliza soluției în electroliză implică moleculele de apă H2O, numai cationii și anionii substanței participă la electroliza topiturii.
1. Scrieți ecuațiile de electroliză a soluției de NaCl.
La catod: 2H2O + 2e¯ = H2 + 2OH¯
La anod: 2Cl2 -2e¯ = Cl2 (gaz)
Forma ionică totală:
2H2O + 2Cl "electroliza H2 + Cl2 + 2 OH"
Total în formă moleculară:
2 H2O + 2NaCl Electroliza H2 + Cl2 + 2 OH
La catod, se eliberează hidrogen, pe anod - clor,
iar în soluție se acumulează NaOH (Na ++ OH)
2. Scrieți ecuațiile de electroliză a soluției KOH
La catod: 2H2O + 2e¯ = H2 + 2OH¯ / 2
La anod: 4OH¯ -4 e¯ = 2H2O + O2 (gaz) / 1
Totalul. 4H2O + 4e + 4OH ÷ 4e2 = 2H2 + 4OH + 2H2O + 02 (gaz)
2 H2Oelectroliza 2H2 (gaz) + O2 (gaz)
La catod, se eliberează hidrogen, oxigenul pe anod,
iar soluția acumulează KOH (K ++ OH)
3. Se scriu ecuațiile de electroliză a topiturii de NaCl.
La catod. Na + + e "= Na (met) / 2
La anod. 2 Cl-2e = Cl2 (gaz) / 1
2 Na + 2 + e + + 2Cl - 2e electroliza 2Na (met) + Cl2 (gaz)
4. Scriem ecuațiile de electroliză a topiturii KOH.
La catod. K + 1 + e * = K (met) / 4
La anod. 4OH-e2 = 2H2O + 20 + 4e
4OH-e2 = 2H2O + 02 + 4e / 1
4K + + 4OH = K (met) + 2H20 + 02
KOH electroliza K (met) + 2H2O + O2
Pentru a calcula câți litri (n.u.) de gaz se eliberează la anod prin electroliza hidroxidului de potasiu, dacă se efectuează electroliza timp de 30 de minute la un curent de 0,5 A, se aplică legea lui Faraday.
Oxigenul este eliberat la anod, cantitatea acestuia fiind determinată de formula care exprimă legea lui Faraday
m = me * I * t / 96500, unde:
m este masa substanței oxidată sau redusă pe electrod;
m este masa molară a echivalentului substanței, mEO2 = 8g
I - puterea curentului, I = 0.5A
t - durata de electroliză, sec, t = 30 * 60 = 1800 sec;
m = me * I * t / 96500 = 8 * 0,5 * 30 * 60/96500 = 0,0746g
Plecând de la faptul că 1r-mol de oxigen (32g) ocupă un volum de 22,4 litri (n.u.), o anumită masă de oxigen 0,0766g va prelua volumul:
0,0746 * 22,4 / 32 = 0,052L (nativ)
Răspuns: în condițiile indicate, la anod va fi eliberat 0,052 l O2.
Subiect: Coroziunea metalelor.
Cum apare coroziunea atmosferică a fierului acoperit cu un strat de nichel în cazul în care stratul de acoperire este rupt? Efectuați ecuațiile electronice ale proceselor catodice și anodice. Care este compoziția produselor de coroziune.
Coroziunea metalului este un proces spontan de distrugere a metalelor ca urmare a interacțiunii cu mediul prin mijloace chimice sau electrochimice.
Reacțiile de oxidare-reducere apar în timpul coroziunii electrochimice, adică Două procese sunt obligatorii: anodice și catodice.
Coroziunea electrochimică a metalului curge atunci când metalul este într-o soluție apoasă sau într-o atmosferă umedă. Coroziunea, care curge într-o atmosferă umedă, se numește atmosferică. Oxigenul este oxidantul.
Procesul anodic de distrugere a metalelor (oxidare) este exprimat prin ecuația:
Reducerea catodică a moleculelor de oxigen dizolvate în apă:
Să analizăm modul în care are loc coroziunea atmosferică a fierului cu un strat deteriorat de nichel.
Să determinăm poziția perechilor galvanice formate într-o serie de tensiuni.
Luăm în considerare regula că un metal având o valoare numerică mai mică E °; situate într-o serie de tensiuni de mai sus, vor prezenta proprietăți de reducere mari ca o substanță simplă, adică Acest Me ° servește ca un anod și emite electroni
Prin urmare, în acest exemplu de realizare, fierul având o valoare numerică inferioară în seriile de solicitare decât nichelul va suferi oxidare:
Fe ° - 2e¯ = Fe + 2 - la anod;
1 / 2O2 + H2O + 2e¯ = 2 ОН ¯ - pe catod.
Mai mult, cationii de fier se vor combina cu gruparea hidroxil, formând o structură insolubilă (vezi tabelul de solubilitate) Fe (OH) 2
Articole similare
-
Principiul de funcționare, precum și principalele tipuri de lasere
-
Tatuaj tatuaj - sensul și tratamentul tatuajelor, schițelor și fotografiilor
-
Registrul de lucru bactericide lampă - pagina 2 - forum de asistente medicale
Trimiteți-le prietenilor: