Ambele componente sunt nelimitate în stare lichidă, limitate în solid și nu formează compuși chimici.
Fazele: L. α, β.
În aliajele de acest fel, este posibilă existența unei faze lichide, a unei soluții solide a componentei B în A, pe care o vom numi o soluție a și o soluție solidă a componentei A în B, pe care o denotăm cu β. În aceste aliaje este posibil un echilibru neviarian cu coexistența simultană a trei faze: L. α, β. În funcție de ce se produce reacția în condițiile existenței a trei faze, pot exista două tipuri de diagrame: o diagramă cu un eutectic și o diagramă cu peritectică.
Diagrama cu peritectic
Într-o transformare eutectică, lichidul cristalizează pentru a forma două faze solide. Un alt tip de transformare nonvariantă (echilibru trifazat) este de asemenea posibil atunci când lichidul reacționează cu cristalele precipitate anterior și formează un nou tip de cristale L + β → α
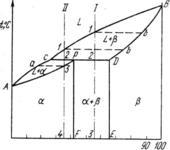
O reacție de acest tip se numește peritectic. Diagrama cu transformare peritectică este prezentată în Fig. Diagrama prezintă trei regiuni monofazate: L lichid și soluții solide limitate de α și β.
Linia ABC este linia liquidus, linia APDB este linia solidus.
Cristalizarea aliajului I. Cristalizarea începe la punctul 1. Când cristalele soluției β a compoziției de la punctul b cad din lichid. Apoi, ca fluid scădere a temperaturii se modifică concentrația sa de pe linia lichidus de la punctul 1 la punctul C, iar cristalele p - linia solidus a punctului b la punctul D. La atingerea compoziției orizontale peritectic lichide DPC va întâlni punctul C, iar compoziția de cristal - punctul D. Aceste două faze reacționează și dau a treia fază a, a cărei concentrație este determinată de punctul ρ - al treilea punct pe orizontală. Reacția peritectică este reprezentată după cum urmează:
LC + β D → α P sau mai general L + β → α deoarece punctele D și ρ arată concentrația de limitare a soluțiilor solide de β și α (pentru simplitate, liniile limită de solubilitate sunt verticale). Raportul cantitativ de fază pentru reacția peritectică, necesar pentru formarea fazei α, este determinat de regula segmentelor prin relația
Numărul β = CP
În același aliaj, numărul de cristale β și lichide care participă la reacția peritectică este determinat de relația
Numărul β = C2
adică în acest aliaj există un exces de fază β în comparație cu cantitatea necesară pentru formarea cristalelor α. Prin urmare, la terminarea reacției, cristalele β rămân în exces. În consecință, structura va conține produsele reacției peritectice (adică, cristalele α) și reziduurile rămase în exces de cristale β. Punctul de apropiere 2 se află la punctul P. Cu cât mai puțin cristalele β rămân în reacție.
Pentru aliajul care corespunde concentrației punctului P, raportul dintre lichid reacționează la peritectic cristalele de transformare și p, astfel încât este suficientă doar pentru a forma cristale, concentrația α.
În Fig. și este prezentată curba de răcire a aliajului I. Cristalizarea peritectică (schema de mijloc) se caracterizează prin faptul că apare o nouă fază a la limita fluidului care reacționează unul cu celălalt și cu cristalele β. Pentru aliajul I, reacția peritectică încheie procesul de cristalizare.
Cristalizarea aliajului II (figura b). Spre deosebire de cristalizarea aliajului din cristalizarea aliajului I este temperatura peritectic la care există un exces de fază lichidă, în comparație cu cantitatea care este necesară pentru formarea cristalelor, concentrația α P. transformare De aceea peritectică se termină epuizarea soluției-β solid, iar lichidul care rămâne în intervalul dintre punctele 2'-3 cristalizează în faza α. În acest caz, concentrația lichidului se modifică de-a lungul curbei C-a, iar concentrația cristalelor α-formate este de-a lungul lui ρ-3.
Site-ul conține informații tehnice și de reglementare privind metalurgia.
Toate materialele postate pe site sunt oferite gratuit.
Articole similare
Trimiteți-le prietenilor: