Caracteristică generală a oxigenului
Oxigenul este al optulea element al tabelului periodic. Denumirea este O de la oxigenul latin. Situat în a doua perioadă, grupul VIA. Se referă la metale nemetalice. Încărcarea nucleului este de 8.
Oxigenul este elementul cel mai comun al crustei pământului. Într-o stare liberă se află în aerul atmosferic, legat într-un fel de apă, minerale, roci și toate substanțele din care sunt construite organisme de plante și animale. Fracțiunea de masă a oxigenului din scoarța pământului este de aproximativ 47%.
Sub forma unei substanțe simple, oxigenul este un gaz incolor care este inodor. Este puțin mai greu decât aerul: masa de 1 litru de oxigen în condiții normale este de 1,43 g și 1 l de aer 1,293 g. Oxigenul este dizolvat în apă, deși în cantități mici: 100 volume de apă la 0 ° C sunt dizolvate cu 4,9 și la 20 ° C - 3,1 volume de oxigen.
Masa atomică și moleculară a oxigenului
Masa atomică relativă Ar este masa molară a atomului substanței, raportată la 1/12 din masa molară a atomului de carbon-12 (12C).
Masa atomică relativă a oxigenului atomic este de 15999 amu.
Greutatea moleculară relativă Mr este masa molară a moleculei, raportată la 1/12 din masa molară a atomului de carbon 12 (12 ° C).
Este o cantitate fără dimensiuni. Se știe că molecula de oxigen este diatomică - O2. Greutatea moleculară relativă a moleculei de oxigen va fi:
Allotropia și modificările alotrope ale oxigenului
Oxigenul poate exista sub forma a două modificări alotrope - oxigenul O2 și ozonul O3 (proprietățile fizice ale oxigenului sunt descrise mai sus).
În condiții normale, ozonul este gaz. Din oxigen poate fi separat prin răcire puternică; ozonul este condensat într-un lichid albastru care fierbe la (-111,9 ° C).
Solubilitatea ozonului în apă este mult mai mare decât cea a oxigenului: 100 de volume de apă la 0 ° C dizolvă 49 de volume de ozon.
Formarea ozonului din oxigen poate fi exprimată prin ecuația:
Izotopii oxigenului
Se știe că în natură oxigenul poate fi sub forma a trei izotopi 16O (99,76%), 17O (0,04%) și 18O (0,2%). Numărul lor de masă este de 16, 17 și, respectiv, 18. Nucleul atomului izotopului de oxigen 16 O conține opt protoni și opt neutroni, iar izotopii 17 O și 18 O- sunt aceiași număr de protoni, respectiv nouă și respectiv zece neutroni.
Există douăsprezece izotopi radioactivi de oxigen cu număr de masă de la 12 la 24, dintre care izotopul 15 O cu un timp de înjumătățire de 120 s este cel mai stabil.
Oxi de ioni
La nivelul energiei externe a atomului de oxigen există șase electroni care sunt valenți:
Structura atomului de oxigen este prezentată mai jos:
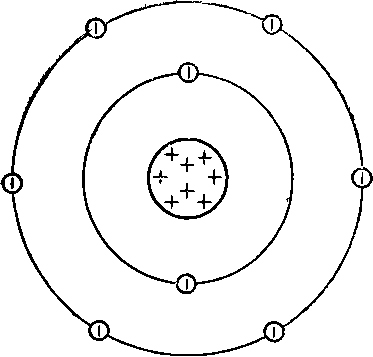
Ca urmare a interacțiunii chimice, oxigenul își poate pierde electronii de valență, i. E. să fie donatorul lor și să se transforme în ioni încărcați pozitiv sau să ia electronii unui alt atom, adică să fie acceptorul lor și să se transforme în ioni încărcați negativ:
0 + 2e → 0 2-;
0 0 -1e → 0 1 +.
Molecule și atom de oxigen
Molecula de oxigen este formată din doi atomi - O2. Iată câteva proprietăți care caracterizează molecula atomică și oxigen:
Articole similare
Trimiteți-le prietenilor: