Baterie - o sursă chimică de curent, care are capacitatea de a acumula și de a stoca pentru o perioadă de timp energia electrică și, dacă este necesar, să o readucă la circuitul extern.
Bateria însăși nu produce energie electrică. Se acumulează numai la o încărcătură: fluxul de curent de la o sursă externă este însoțit de transformarea energiei electrice într-una chimică, astfel încât bateria însăși devine o sursă de curent.
Când bateria este descărcată, energia electrică acumulată este consumată în circuitul extern conectat la ea (energia chimică este transformată în energie electrică).
Atunci când este utilizat corect, bateria poate rezista la mai multe sute de cicluri de încărcare și descărcare.
În funcție de compoziția electrolitului se disting:
· Și baterii alcaline.
Cel mai simplu acumulator acid este compus din doi electrozi de plumb imersați într-o soluție de acid sulfuric.
Procesele care apar în acumulatorul acid pot fi reprezentate prin următoarea ecuație:
PbSO4 - sulfat de plumb (sulfat de plumb).
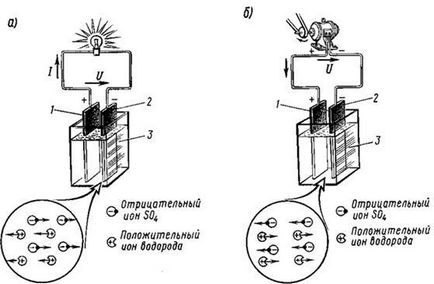
Figura 4.2. Trecerea prin electrolit a ionilor pozitivi și negativi într-o descărcare și b) încărcarea bateriei cu acid
La locomotivele și trenurile electrice cea mai mare distribuție a fost obținută de acumulatorii alcalini (o durată de viață mult mai mare decât cea a celor acide).
Un acumulator complet încărcat are o baterie emf. aproximativ 2.2 V, aproximativ aceeași tensiune la terminalele sale, deoarece rezistența internă este foarte mică.
La descărcarea de gestiune, tensiunea scade rapid la 1,8-1,7 V, la această tensiune descărcarea se oprește pentru a evita deteriorarea.
Cele mai obișnuite baterii alcaline nichel-fier (NC) și nichel-cadmiu (NK). În ambele cazuri, masa activă a electrodului pozitiv în starea încărcată constă din hidratul de nichel NiOOH, la care se adaugă grafitul și oxidul de bariu.
Grafitul mărește conductivitatea electrică a masei active, iar oxidul de bariu - durata de viață. Masa activă a electrodului negativ al bateriei nichel-fier constă din fier pulverizat cu aditivi și o baterie de nichel-cadmiu realizată dintr-un amestec de pulbere de cadmiu și fier. Electrolitul este o soluție de potasiu caustic cu un amestec de monohidrat de litiu, care mărește durata de viață a bateriei.
Reacțiile electrochimice care apar în timpul încărcării și descărcării bateriei alcaline pot fi reprezentate de următoarele ecuații:
2Ni (OH) + 2KOH + Fe2Ni (OH) 2 + 2KOH + Fe (OH) 2
2Ni (OH) + 2KOH + Cd2 Ni (OH) 2 + 2KOH + Cd (OH) 2
Ni (OH) - hidrat de oxid de nichel;
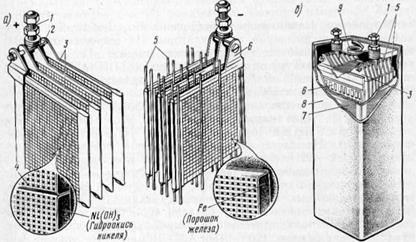
Figura 4.3. Semi-blocurile plăcilor negative și pozitive (a) și viziunea generală (b)
nichel-fier TPNZH, utilizat pe locomotive diesel:
1 - pinul de ieșire; 2 - ac de păr; Plăci cu 3 poziții; 4 - cadre din oțel nichelat (lamele); 5 - separatoare; 6 - plăci negative; 7 - locuințe;
8 - un capac din cauciuc; 9-gaura cu dop pentru umplerea electrolitului
Figura 4.4. Semi-blocuri de plăci negative și pozitive (a) și vedere generală (b) a acumulatorului de nichel-cadmiu NKN-100 pentru epf. 1 - plăci negative; 2 - punte de legătură; 3 - știftul de ieșire; Plăci cu 4 poziții; 5 - o gaură cu capac pentru umplerea electrolitului; 6 - acoperire; 7 - separator; 8 - locuințe; 9 - capac din cauciuc
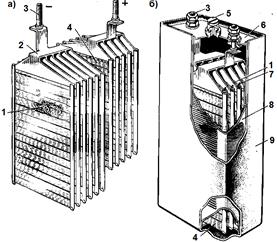
Un acumulator complet încărcat are o baterie emf. aproximativ 1,45 V. Datorită rezistenței interne mari, tensiunea la deversare este mult mai mică decât această valoare. Când este descărcată, tensiunea scade rapid la 1,3 V, apoi lent până la 1 V. Este interzisă descărcarea sub această tensiune.
Avantajele bateriilor alcaline:
· Nu folosesc plumb limpede;
· Au o rezistență mai mare și o rezistență mecanică, nu se tem de curenți puternici de descărcare, tremurături, șocuri și chiar scurtcircuite;
· Cu inactivitate îndelungată, duceți pierderi mici la auto-descărcare și nu vă deteriorați, aveți o durată lungă de viață;
· Gazele și vaporii mai puțin periculoși sunt eliberați în timpul funcționării;
· Să aibă o greutate mai mică;
· Mai puțin exigent în ceea ce privește îngrijirea constantă calificată.
· Eficiență scăzută
Cost mai mare.
1. Care este scopul bateriei?
2. Principiul bateriei cu acid.
3. Principiul bateriei alcaline.
4. Avantajele bateriilor alcaline.
5. Dezavantaje ale bateriilor alcaline.
6. Care este emf. o baterie complet încărcată?
7. Ce constă din cea mai simplă baterie acidă?
8. Care sunt numele dispozitivelor care transformă energia chimică în energie electrică?
9. Ce este un electrolit?
10. Ce este electroliza?
11. Care sunt componentele moleculei de acid sulfuric?
12. De ce constă celula Volta?
13. Cum polarizează elementul?
14. Care este efectul ionilor de hidrogen asupra funcționării bateriei?
15. Ce este o celulă galvanică uscată?
16. Cum funcționează un curent electric în conductorii lichizi?
17. Care este designul bateriilor cu acid?
19. Cum se încarcă bateriile?
20. Care este semnul sfârșitului încărcării în bateria acidă?
21. Care este semnul sfârșitului încărcării pentru o baterie alcalină?
Cum pot conecta bateriile la baterie?
4.3. Modalități de conectare a bateriilor la baterie
Consecvent. Când minus fiecare sursă anterioară este conectată cu plusul următorului. Conform celei de-a doua legi a lui Kirchhoff, rezultatul emf. este egală cu suma emf. baterii individuale. Cele mai multe baterii din circuit, cu atât mai mare este tensiunea pe receptoare.
Dacă bateria este închisă la rezistența externă R, atunci
Conectați în mod secvențial bateriile atunci când tensiunea consumatorului este mai mare decât tensiunea unei baterii.
Paralel. atunci când clemele pozitive ale mai multor baterii sunt conectate unul la celălalt și ieșesc la un plus comun, iar clemele negative sunt conectate una la cealaltă și se transmit la un minus comun.
Figura 4.5. Tensiunea aplicată receptorului, cu un număr diferit de baterii conectate în serie
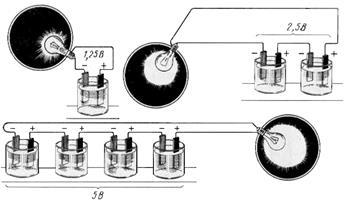
Conexiunea paralelă este utilizată atunci când tensiunea consumatorului este egală cu tensiunea unei baterii, iar curentul solicitat de consumator este mai mare decât curentul de descărcare al unei baterii.
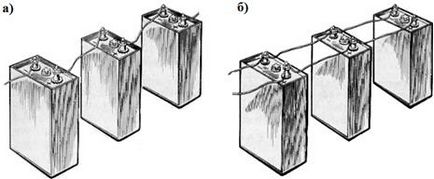
Figura 4.6. Serial (a) și paralel (b) conexiuni la baterie
O conexiune mixtă este utilizată atunci când bateriile nu oferă posibilitatea de a obține curentul și tensiunea necesare. În Fig. 4.7 în fiecare dintre cele două grupuri paralele ale bateriei, există două baterii conectate succesiv.
Figura 4.7. Amestecarea bateriei mixte
Bateriile în majoritatea cazurilor sunt alcătuite din baterii conectate în serie. Conectarea paralelă și paralelă a bateriilor este rar utilizată, deoarece Este dificil să se asigure o distribuție uniformă a curentului între ramurile paralele.
1. Ce tipuri de conexiuni pentru baterii știți?
2. Care este esența conexiunii în serie a bateriilor?
3. Ce conexiune la baterie se numește paralel?
4. Ce legătură de baterie se numește mixtă?
Articole similare
Trimiteți-le prietenilor: