Comunicare simplă
Cel mai simplu compus organic este metanul. Molecula sa constă din cinci atomi - un atom de carbon și patru atomi de hidrogen, distribuite uniform în spațiul din jurul acestui atom central de carbon. Aici, întâlnim mai întâi cel mai important postulat al chimiei organice: în toate moleculele nefolosite organice, carbonul este întotdeauna tetravalent. Acest lucru este exprimat grafic prin faptul că trebuie să fie conectat la simbolurile chimice ale altor elemente sau același carbon prin patru liniuțe. În metan, toți cei patru atomi de hidrogen sunt la aceeași distanță față de atomul de carbon și sunt cât mai îndepărtați posibil unul față de celălalt în spațiu.
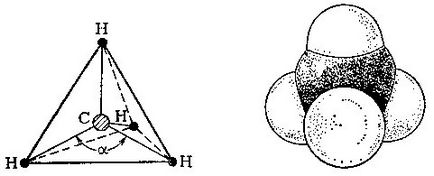
În molecula de metan, atomul de carbon este în centrul tetraedrului obișnuit și patru atomi de hidrogen sunt la vârfurile sale.
Deci, molecula de metan pare să țină cont de dimensiunile atomilor.
Pentru a construi un model al unei molecule, să luăm un tetraedru, adică un tetraedru obișnuit alcătuit din triunghiuri echilaterale, și să punem un atom de carbon în centrul său. Atomii de hidrogen vor fi localizați de-a lungul vârfurilor tetraedrului. Conectăm tot hidrogenul la atomul central de carbon. unghi # 945; între aceste două linii va fi 109 grade și 28 de minute.
Așadar, am construit un model de metan. Dar care sunt dimensiunile moleculelor în realitate? În ultimele decenii, prin metode fizice de investigare (acestea sunt discutate în avans), este posibil să se determine cu precizie distanțele interatomice din moleculele de compuși organici. În molecula de metan, distanța dintre centrele atomului de carbon și orice atom de hidrogen este de 0,109 nm (1 nanometru, nm, egal cu 10-9 m). Pentru a vizualiza ceea ce arată molecula în spațiu, utilizați modelele Stuart-Brigley, în care atomii sunt reprezentați de bile de o anumită rază.
Acum, să ne întrebăm: ce forțe leagă atomii în molecula unui compus organic, de ce atomii de hidrogen nu se îndepărtează de centrul de carbon?
Atomul de carbon constă dintr-un nucleu încărcat pozitiv (sarcina lui este de +6) și șase electroni care ocupă diferite orbite * în jurul nucleului, fiecare dintre acestea corespund unui anumit nivel de energie.
* (Orbitalul poate fi considerat o regiune a spațiului în care probabilitatea de a găsi un electron este mai mare)
Doi electroni ocupă cea mai mică orbită cea mai apropiată de nucleu. Ei interacționează cel mai intens cu nucleul "propriu" și nu participă la formarea legăturilor chimice. Un alt lucru sunt ceilalți patru electroni. Să considerăm că așa-numitul atom de carbon neexcitat, adică, într-un atom separat, nu formează nici legături cu alți atomi, acești electroni sunt aranjate după cum urmează: .., Doi pe subnivelul inferior și doi s la un subnivel superior p. Într-un mod oarecum simplificat și schematic, putem presupune că norul format de un electron situat la nivelul s este sub forma unei sfere. Nori de electroni p arată ca volumul opt, iar aceste opt figuri pot fi situate în spațiu de-a lungul axelor x, y și z. În conformitate cu aceasta, în fiecare atom există trei p-orbite: px. py și pz. Deci, fiecare orbital din atom are o formă definită și este situat într-un mod special în spațiu.
Pentru a interacționa cu alți atomi, pentru a forma legături chimice cu aceștia, atomul de carbon trebuie să intre într-o stare specială, excitată. În acest caz, un electron sare de la s-orbitale la p-orbital. Ca rezultat, un electron ocupă o sferă sferică sferică, iar ceilalți trei electroni formează trei orbite-opt. Cu toate acestea, o astfel de situație este neeconomică pentru un atom. Energia inferioară a unui atom corespunde cu patru orbite identice, dispuse simetric în spațiu. Prin urmare, se produce amestecarea, medierea sau, după cum se spune, hibridizarea orbitalilor existenți. iar rezultatul este patru orbite identice noi.
Acești orbitali-hibrizi sunt, de asemenea, asemănători celor opt, dar cei opt sunt unul față-verso: densitatea electronilor este aproape complet deplasată într-o direcție. Asemenea orbitale hibridizate sunt desemnate sp 3 (în termeni de număr de electroni din diferite orbitali nehibrizi care participă la formarea lor: unul cu s-orbitali și trei cu p-orbital).
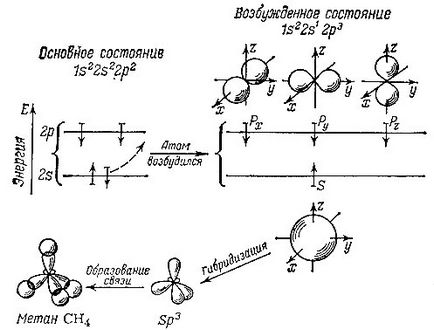
Aici, hibridizarea orbitalilor este prezentată schematic în formarea moleculei de metan. Săgețile indică direcția relativă a rotirilor electronilor
Cum este construită molecula de metan? Fiecare dintre cele patru orbitali hibrizi de atomi de carbon orientate în direcții diferite (sau, mai degrabă, în colțurile unui tetraedru imaginar care poate fi construit în jurul acestuia), atomi de hidrogen se potrivesc N. atom vodoroda- acest nucleu cu o încărcătură de 1 (pentru izotop luminii obișnuite de hidrogen - un proton) și un electron care ocupă o orbită sferică în jurul protonului. Nori de electroni "carbon" și "hidrogen" se suprapun, ceea ce înseamnă formarea unei legături chimice. Cu cât sunt mai multe suprapuneri de electroni de atomi diferiți, cu atât este mai puternică legătura. Acum devine clar de ce orbitalii hibridizate profitabile - pentru că o astfel de o singură față, proeminente pe de o parte opt poate mult mai mult se suprapun cu norul de electroni de hidrogen, cu atât mai puțin extinse în spațiu nu este orbitali hibrid. Observăm că aceste argumente sunt oarecum arbitrare: un atom de carbon curat, așa de vorbit, unic și inexplicabil nu există. Prin urmare, nu are sens să discutăm cum au loc toate aceste transformări orbitale, numite hibridizare. Cu toate acestea, pentru a facilita descrierea legăturilor chimice prin intermediul unor formule și numere, convențiile se dovedesc a fi utile. Vom vedea acest lucru din nou și din nou.
Cum se obține metanul?
Una dintre cele mai simple moduri este de a acționa pe apă pe carbură de aluminiu:
Cu toate acestea, carburile de aluminiu sunt prea scumpe ca materie primă pentru a produce un produs obișnuit și ieftin ca metan și nu este necesar să se obțină de la alți compuși - de fapt, gazul natural este de 85-98% metan.
Metanul este una dintre principalele "cărămizi" din care este posibil să se construiască compuși organici. Ce sunt acești compuși și cum să le obții din metan?
De fapt, metanul - o substanță relativ inertă și un set de reacții chimice care pot fi realizate cu acesta, sunt mici.
Luați un amestec de două gaze - metan și clor și puneți-l într-un vas de sticlă. Dacă acest vas este ținut în întuneric, atunci nu se observă nici o reacție. Dar să încercăm să iluminăm sticla cu lumina soarelui.
Cuantele de lumină interacționează cu o moleculă de clor, ca rezultat, molecula se împarte în două părți - două atomi de clor:
Atomii care rezultă sunt mult mai activi decât moleculele, atacă imediat moleculele de metan și captează atomi de hidrogen. În acest caz se formează molecule de acid clorhidric HCI și particule foarte active, foarte active, așa-numitele radicali metil # 8901; CH3.
Radicalul metil în continuare "scindează" molecula de clor:
Rezultatul este deja cunoscut un atom de clor (ușor pentru a prezice viitorul soarta: ea ataca noi molecule de metan și toate se repetă) și clormetan, clorură de metilen sau - un derivat de metan, în care unul dintre atomii de hidrogen înlocuiți cu clor.
Reacția, pe care am descris-o, aparține categoriei așa-numitelor reacții în lanț. în care fiecare etapă, ca într-un lanț, este legată de precedentul și ulterior. Particulele active sunt un produs al unei etape (aici sunt atomi de clor și radicali metil) # 8901; CH3) - se utilizează în etapa următoare ca materii prime. Descoperirea reacției în lanț a fost unul dintre cele mai importante evenimente din istoria chimiei, și academicianul NN Semenov și savantul englez SN Hiishelvud pentru contribuția sa la studiul unor astfel de reacții și crearea de teoriile lor au primit Premiul Nobel.
Dacă introducem în reacție astfel de cantități de reactivi ca două molecule de metan pe moleculă de clor, atunci în principiu obținem clorură de metil CH3CI. Dacă, pe de altă parte, clorul este luat în exces, reacția de substituție va merge mai departe și, în plus față de clorura de metil, se va obține, de asemenea, clorura de metilen, CH2CI2. cloroformul CHCl3 și, în final, produsul substituției complete a hidrogenului pentru clor, tetraclorura de carbon CC14.
Dar să nu uităm de sarcina noastră: de a construi diferite molecule complexe din molecule simple de metan-cărămidă. Pentru aceasta avem nevoie de clorură de metil. Dacă acest compus este acționat cu sodiu metalic, atunci din fiecare două molecule CH3CI, se formează o moleculă de etan, în care există o legătură carbon-carbon:
Ce este etanul? Acesta este metanul, în care unul din hidrogen este înlocuit cu un radical metil # 8901; CH3. Și acest radical, după cum deja știm, se obține prin îndepărtarea unui atom de hidrogen din metan.
Dacă acum, în etan pentru a înlocui unul dintre hidrogen (orice atom) cu metil, atunci vom obține o substanță nouă - propan CH3-CH2-CH3. Cum acest lucru poate fi realizat în practică, știm: mai întâi, în metan și etan înlocuiți unul clor hidrogen, și apoi să acționeze asupra unui amestec de metil și clorură de etil, sodiu (această reacție se numește reacția Wurtz după chimist francez care a descoperit-):
Să mergem mai departe. Vom înlocui în propan unul dintre atomii de hidrogen per clor. Se pare că nu este același lucru cu ce atom de înlocuit! Înlocuind hidrogenul cu un atom de carbon extrem (există doi astfel de atomi) sau cu un atom mediu, obținem doi compuși diferiți: clorură de propil (clorură de n-propil) și clorură de izopropil:
Să înlocuim acum în fiecare dintre acești compuși atomii de clor din grupările metil. Vom primi două butane diferite - butan (n-butan) și izobutan normal (adică neramificat):
Am pus moleculele rezultate pe "cărămidă". Să începem cu n-butan. Aici se poate înlocui unul dintre ultimii atomi de hidrogen cu metil. Avem un pentan normal. Se poate înlocui unul dintre hidrogenul mediu. Vom ajunge la izo-pentan. Aparent, nu veți obține nimic nou de la n-butan. Să ne întoarcem la izobutan. Dacă în ea se înlocuiește unul dintre hidrogenii extreme (în grupările CH3), atunci ajungem la izopentanul menționat anterior și înlocuim atomul mediu de hidrogen unic, obținem neopentan:
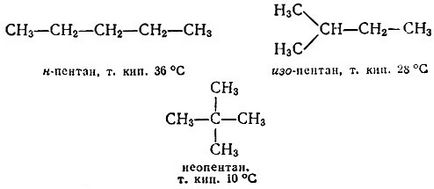
Continuați această procedură este fără sfârșit. Toți acești compuși sunt numiți hidrocarburi (mai precis - limitați, hidrocarburi saturate sau alcani), deoarece ele constau doar din două elemente - carbon și hidrogen. În orice alcan, numărul de atomi de hidrogen este 2n + 2, unde n este numărul de atomi de carbon. Prin urmare, formula pentru hidrocarbură finală poate fi scrisă în forma generală după cum urmează: Cn H2n + 2.
În construcția structurilor noastre, trebuie să spunem, a încetat în timp. Faptul este că numărul izomerilor posibili crește catastrofic rapid, odată cu creșterea numărului de atomi de carbon din molecula de alcan. Deci, pentru decan, hidrocarbură C10H22. probabil 75 izomeri diferiți, numărul izomerilor pentru hidrocarbură C20H42 (eikozan) este 366 319. Numărul de izomeri posibili pentru tetracontan, hidrocarbură C40H82. chiar greu de imaginat: 62,491,178,805,831.
Acum devine clar de ce atât de mulți compuși organici sunt deja cunoscuți astăzi - câteva milioane - și de ce chimia organică a depășit cu mult chimia anorganică în acest sens. Dar până acum s-au vorbit doar despre cei mai simpli reprezentanți ai substanțelor organice despre hidrocarburile saturate.
Am eliminat un număr de hidrocarburi izomerice din metan, utilizând reacția Wurz. Cu toate acestea, în practică, nimeni nu face acest lucru. Faptul este că cele mai simple hidrocarburi, împreună cu metanul, sunt conținute în gazele naturale, compoziția cărora este diferită pentru depozitele diferite. De exemplu, în gazul din câmpul Stavropol de Nord, sunt conținute 85% metan, aproximativ 5% etan, 2,5% propan și 1,4% pentan și hidrocarburi mai grele. Gaz de gazinskoye câmp constă din metan cu 98%, etan în el este de numai 1,6%. Multe hidrocarburi sunt în ulei, dar acest lucru se întâmplă în următoarele capitole.
Hidrocarburi inferioare - metan, etan, propan și butan - gaze incolore, inodore sau cu un miros slab de benzină. Hidrocarburile din pentan până la pentadecan C15H32 sunt lichide și, în final, hidrocarburile mai mari la temperatura obișnuită sunt solide.
Câteva exemple de utilizare a metanului
Odată cu creșterea numărului de atomi de carbon, se mărește punctul de fierbere și punctul de topire al compusului.
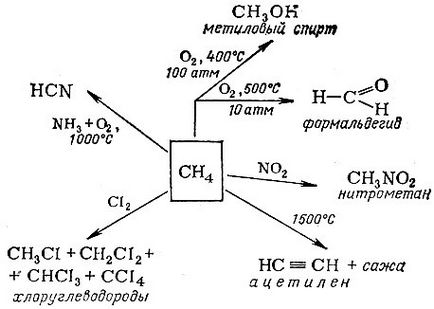
Hidrocarburile limitate au un alt nume - parafine. reflectând inerția lor chimică (în latină parum affinis - o mică afinitate). Și totuși acestea sunt utilizate pe scară largă în industria chimică pentru a produce o mare varietate de substanțe. Direcțiile principale de utilizare industrială a metanului sunt prezentate în diagramă.
Înainte de a termina conversația despre metan și hidrocarburi saturate, răspundem la o întrebare: cum este legătura dintre parafinele dintre doi atomi de carbon, de exemplu, în etan? Aici totul este simplu: în jurul fiecărui atom de carbon există, ca și în metan, patru sp3-orbitali hibridizați, dintre care trei realizează legături cu atomi de hidrogen și unul se suprapune exact cu aceeași orbitală a altui atom de carbon. Lungimea legăturii C-C este de 0,154 nm.
Trimiteți-le prietenilor: