Pregătirea pentru perceperea unui material nou.
- Care sunt principalele puncte ale teoriei moleculare a structurii materiei?
- Care este relația dintre viteza de mișcare a moleculelor și temperatura corpului?
- Ce energie au moleculele ca rezultat al mișcării lor? Din cauza interacțiunii?
- Ce fel de energie se numește internă?
- Cum poți schimba energia internă?
- În care state agregate poate exista materie?
- Poate o substanță să fie simultan în trei stări agregate?
- Modifică moleculele atunci când o substanță trece de la o stare la alta?
Lichidul este o stare agregată de materie intermediară între gaz și solid.
Aceasta este o stare agregată a unei substanțe în care moleculele (sau atomii) sunt legate atât de mult încât le permite să își mențină volumul, dar nu suficient de puternic pentru a le menține și a le forma.
Lichidele datorate naturii diferite a mișcării moleculelor diferă semnificativ de gaze și solide.
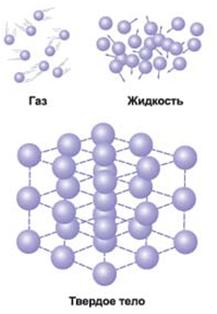
Moleculele de materie în stare lichidă sunt situate aproape în strânsă legătură între ele. Spre deosebire de solide cristaline, în care moleculele formează structuri ordonate pe tot cristalul și pot face oscilații termice circa centrele fixe, moleculele lichide au mai multă libertate. Fiecare moleculă a lichidului, precum și în stare solidă, „prinse“ pe toate laturile de moleculele învecinate și face oscilații termice aproximativ o anumită poziție de echilibru. Cu toate acestea, din când în când, orice moleculă se poate muta într-un loc vacant învecinat. Astfel de salturi în lichide apar destul de des; astfel încât moleculele nu sunt atașate la anumite centre, ca și în cristale, și pot călători în întregul volum al lichidului. Aceasta explică fluiditatea lichidelor. Lichidul are întotdeauna forma vasului în care este amplasat.
Fluiditatea fluidului este explicată prin "săriturile" moleculelor dintr-o poziție stabilită în alta în toate direcțiile cu aceeași frecvență.
Datorită interacțiunii puternice dintre moleculele situate îndeaproape, ele pot forma grupuri ordonate locale (instabile) care conțin mai multe molecule. Acest fenomen se numește ordine cu rază scurtă de acțiune:
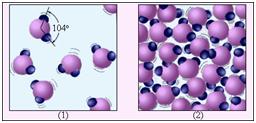
Un exemplu de ordonare cu rază scurtă de molecule lichide și molecule de comandă cu rază lungă de acțiune ale unei substanțe cristaline: 1 - apă; 2 - gheață.
În lichid, există o ordine cu rază scurtă în aranjarea moleculelor și nu există ordine cu rază lungă de acțiune.
Figura de mai jos ilustrează diferența dintre o substanță gazoasă și un lichid prin exemplul de apă. Molecula de apă H2O constă dintr-un atom de oxigen și doi atomi de hidrogen localizați la un unghi de 104 °. Distanța medie dintre moleculele de vapori este de zeci de ori mai mare decât distanța medie dintre moleculele de apă.
Datorită ambalării strânse a moleculelor, compresibilitatea lichidelor, adică schimbarea volumului cu o schimbare a presiunii, este foarte mică; este zeci și sute de mii de ori mai puțin decât în gaze.
Lichidul este practic incompresibil.
Expansiunea termică a lichidelor.
Lichidele, cum ar fi cele solide, își schimbă volumul pe măsură ce se schimbă temperatura. Când lichidul este încălzit, crește energia cinetică medie a mișcării haotice a moleculelor sale. Aceasta conduce la o creștere a distanței dintre molecule și, în consecință, la o creștere a volumului. Expansiunea termică a lichidelor este caracterizată printr-un coeficient de temperatură de expansiune volumetrică.
Pentru intervale de temperatură care nu sunt foarte mari, variația relativă a volumului ΔV / V0 este proporțională cu schimbarea temperaturii ΔT:
Coeficientul β se numește coeficientul de temperatură al expansiunii volumetrice.
Acest coeficient în lichide este de zece ori mai mare decât cel al substanțelor solide.
La apă la o temperatură de 20 ° C, ββ ≈ 2 · 10 -4 K -1. în oțel, β st ≈ 3,6 · 10 -5 K -1. pentru sticlă de cuarț, β kv ≈ 9 · 10 -6 K -1.
Cu o creștere a volumului de corpuri, densitatea lor scade. Denotând cu ρ și ρ0 densitățile la temperaturile T și respectiv T0, luând în considerare faptul că ρ = m / V, obținem ρ = ρ0 / (1+ β ΔT)
Articole similare
Trimiteți-le prietenilor: