Structura atomică-cristal este înțeleasă ca aranjament reciproc al atomilor (ionilor) existenți într-un cristal real.
În stare solidă, metalul este un ansamblu format din ioni încărcați pozitiv spălați de un "gaz" de la electroni liberi colectivizați. Legătura în metal se realizează prin forțe electrostatice. Între ioni și electronii de conducere colectivizați, apar forțe electrostatice de atracție care trag ionii împreună. Această conexiune se numește metalică.
Forțele de legare în metale sunt determinate de forțele de repulsie și forțele atractive între ioni și electroni. Atomii (ionii) sunt localizați la o distanță atât de mare una față de cealaltă, la care energia de interacțiune este minimă.
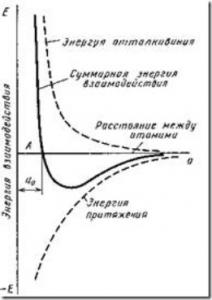
Fig. 4. Schema energiei de interacțiune a doi atomi ca o funcție a distanței interatomice
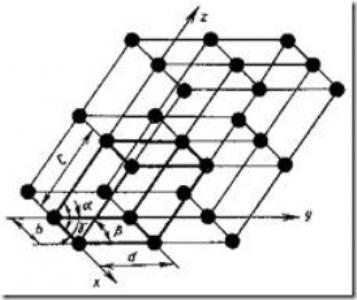
Fig. 5. Schema rețelei de cristal
Așa cum se poate vedea din fig. 4, această poziție corespunde distanței de echilibru a0. Aproximarea atomilor (ionilor) cu o distanță mai mică de a0 sau îndepărtarea lor cu o distanță mai mare decât a0 este posibilă numai atunci când se efectuează o anumită lucrare împotriva forțelor de repulsie și atracție.
Prin urmare, într-un metal, atomii sunt aranjați în mod regulat, formând o latură cristalină obișnuită, care corespunde energiei de interacțiune minimă a atomilor.
Dulap de cristal
Grinzile de cristal (Figura 5) constau din linii și planuri imaginare care trec prin punctele aranjamentului ionilor din spațiu. În liniile îndrăznețe, se deduce cel mai mic paralelipiped, prin mișcare succesivă a cărei lungime pe cele trei axe, poate fi construit întregul cristal.
Cel mai mic volum al cristalului, care dă o idee despre structura atomică a metalului în orice volum, se numește celula elementară de cristal.
Pentru caracteristica sa lipsită de ambiguitate, este necesar să cunoaștem următoarele cantități: trei margini (a, b și c) și trei unghiuri între axe.
Majoritatea metalelor formează una din următoarele laturi de simetrie înaltă, cu o densitate densă de atomi: un centru cubic centrat, cu fața cubică centrat și hexagonal (figura 6).
Așa cum se poate vedea din fig. 6a, într-o latură centrată pe corp cubic (bcc), atomii sunt localizați la vârfurile cubului și un atom din centrul volumului cubului. Rețeaua cubică în vrac are metale: Pb, K, Na, Li, Ti, Zr, Ta, W, V, Fe, Cr, Nb, Ba etc.
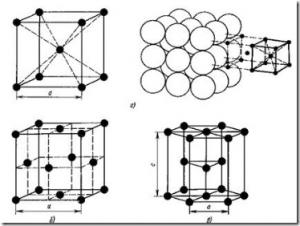
Fig. 6. Grinzile de cristal din metale: a - centrată pe corp cubică (bcc); b - cubic centrat pe față (fcc); în - hexagonale închise (hcp)
Grilaj centrat pe față
Într-o latură cubică centrată pe față (FCC), atomii sunt localizați la vârfurile cubului și în centrul fiecărei fețe (Figura 6, b).
În rețeaua hexagonală (Figura 6, c), atomii sunt localizați la vârfurile și centrul bazelor hexagonale ale prismei și trei atomi în planul mijlociu al prismei.
Distanțele a, b, c între centrele celor mai apropiate atomi dintr-o celulă unică sunt numite perioade de zăbrele. Perioada laturii este exprimată în nanometri (1 nm = 10-9 cm).
Perioadele de latură pentru cele mai multe metale sunt în intervalul 0,1-0,7 nm.
Intr-o unitate de celule centrata pe corp cu zăbrele se încadrează doi atomi, unul în centrul cubului și se introduc alți atomi, care sunt situate în nodurile cubului (partea superioară a fiecărui atom din cub aparține simultan opt celule unitate asociate și această celulă are o greutate de 1/8 a atomului și la întreaga celulă 1/8 X 8 = 1 atom).
Există patru atomi pe unitatea de celulă a unei laturi cubice centrate pe față; una dintre ele (conform aceluiași calcul ca și pentru grilajului cubică cu corp) atomii sunt introduse în nodurile cubului, și în total trei (X (1/2) 6 = 3) fac atomi situate în mijlocul marginii, ca fiecare dintre acestea atomii aparțin două laturi.
Fig. 7. Diagramă care arată numărul de atomi localizați la o distanță egală și mai mică de un atom A dat în diferite laturi cristaline (SS Steinberg): a-K8; b - K12; in - G12
Există șase atomi pe unitatea de celulă dintr-o latură hexagonală închisă (3 + (1/6) X 12 + (1/2) x2 = 6).
densitate zăbrele - volumul ocupat de atomii, care pot fi considerate ca aproximativ bile rigide, caracterizate număr de coordonare prin care se înțelege numărul de atomi într-o distanță egală și cea mai mică dintr-un anumit atom. Cu cât numărul de coordonare este mai mare, cu atât densitatea de ambalare a atomilor este mai mare.
În celula unică a unei rețele cubice centrate pe corp, cea mai mică distanță dintre atomi corespunde d = 0,5 a / 3. La această distanță de atomul dat există 8 vecini (figura 7, a). În consecință, numărul de coordonare pentru rețeaua bcc corespunde la 8 și este notat cu K8. Coeficientul de compactitate al celulei, definit ca raportul dintre volumul ocupat de atomi și volumul celular, este de 68% pentru rețeaua bcc.
Pentru o latură cubică centrată pe față, numărul de coordonare este 12 (K12); fiecare atom are 12 vecini apropiați la o distanță d = 0,5 a / 2 (Figura 7, b), care corespunde celei mai mari densități de ambalare sau stivuire sub formă de sfere. Hexagonala aproape zăbrele ambalate pentru care a / a = 1633, are un număr de coordonare 12 (G12), care corespunde și ambalarea densității maxime de sfere (atomi) (Fig. 7c). Multe metale care cristalizează în sistemul hexagonal, raportul c / a este în intervalul 1,57 - .. 1,64, adică, se poate abate de la cel mai apropiat ambalaj, în cazul în care c / a = 1,633. Dacă raportul c / a diferă semnificativ de la 1,633 (de exemplu, pentru zinc și cadmiu), atunci numărul de coordonare al rețelei hexagonale corespunde cu 6.
Literele cubice și hexagonale închise în centru (c / a = 1.633) sunt cele mai compacte; în ele coeficientul de compactitate este de 74%.
Când numărul de coordonare din rețeaua hexagonală este redus de la 12 la 6, factorul de compactare este de aproximativ 50%, iar cu numărul de coordonare 4, acesta este de numai aproximativ 25%.
Jumătate dintre cele mai mici distanțe dintre atomii din rețeaua cristalină se numesc raza atomică. Raza atomică crește pe măsură ce numărul de coordonare scade, deoarece în acest caz spațiul dintre atomi crește. Prin urmare, razele atomice ale metalelor diferite sunt de obicei reduse la K12.
Materiale conexe
Trimiteți-le prietenilor: