SL. 10 (0) valoarea este 1 / r. inversul rezistivității, numit conductivitatea electrică. Este notată cu litera c (greaca "kappa"), Cu această notație, ecuația (***) ia forma:
(1) Dacă S = 1 cm 2. al-1 cm, atunci L, = c. Electroductivitatea specifică a electrolitului c este reciprocitatea rezistenței coloanei soluției de 1 cm în lungime și a ariei secțiunii transversale de 1 cm2. Conductivitatea specifică în [Ohm-1 * cm-1] este măsurată.
Deoarece soluțiile de electrolit în timpul trecerii-exploatare RE-ionii deplaseze între electrozi și pierde puterea lor numai pe suprafața lor, formula de mai sus reprezintă o suprafață S, l - distanța dintre electrozi.
(2) De exemplu, rezistivitatea unei probe de apă la 18 ° C este r = 2 × 10 6 ohm-cm. Conductivitatea electrică specifică a acestei probe de apă va fi:
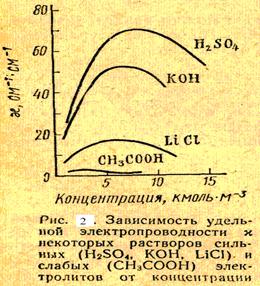
Dacă vom picătură de apă în două zona electrodului de 1 cm2, atunci distanța dintre electrozii de 1 cm și o diferență de potențial de 1 în intensitatea curentului este egală cu 5 • 10 -7 și (la 18 ° C). Conductivitatea electrică a soluțiilor de electroliți depinde de numărul total de ioni ai acestora pe unitatea de volum a soluției. Din acest motiv, conductivitatea electrică a electroliților depinde de concentrația soluției. Deoarece con-centrarea conductibilitate electrolit crește inițial și apoi scade, deoarece odată cu creșterea numărului de ioni scade SKO-o creștere a deplasării lor, iar agentul de disociere bontului-ste. Primul factor acționează în soluții de electroliți puternici, al doilea - în soluții de electroliți slabi. La atingerea factorilor de impact concentrare soluție-op definiteness enumerate sute novitsya atât de mare încât o creștere suplimentară a concentrației conduce la o scădere a electric ness (Fig. 2SL. 11).
Conductivitatea electrică specifică a soluțiilor electrolitice depinde, de asemenea, de proprietățile individuale ale ionilor. Problema este că cantitatea de curent electric transportată de ioni în soluția de electroliți depinde nu numai de numărul de ioni per unitate de volum, ci și de viteza de mișcare a acestora.
Se știe că diferite ioni se mișcă într-un câmp electric cu viteză inegală. În tabel. 1 SL. 12 prezintă valorile vitezei de mișcare a anumitor ioni, referindu-se la o scădere a potențialului la 1 V / cm (viteze de ion absolut).
Viteze de ioni de viteză (cm * sec) în apă la 18 ° C și o diferență de potențial de 1 V / cm
După cum se poate observa din tabel. 1, vitezele mișcării ionice în timpul trecerii unui curent electric sunt, în general, foarte mici în comparație cu vitezele mișcării moleculelor în gaze. Astfel, ionul de hidrogen din mediul apos se deplasează aproximativ o sută de milioane de ori mai lent decât molecula H2 în mediul gazos. Acest lucru se explică prin faptul că ionii din apă sunt hidratați și se confruntă cu o mare rezistență din mediul înconjurător (solvent) în timpul mișcării. Din datele din tabel. 1 arată că ionii de H + și OH - au peste toți ceilalți ioni cele mai mari viteze absolute, care nu poate fi reprezentat doar o mică mustață-ioni H + și OH -. Raza OH - -ion (1,40A °) corespunzătoare cu raze de alți ioni, ionul H + în soluție apoasă există numai sub formă de ioni de hidroniu H3 O +. a cărui rază este de asemenea comparabilă cu razele multor ioni.
Conductivitatea electrică a soluțiilor depinde, de asemenea, de încărcarea ionică: cu cât este mai mare, cu atât este mai mare cantitatea de energie electrică pe care ionul o transferă de la un electrod la celălalt. Astfel, fiecare anion împărțit dublu dă doi anonzi anodului, iar un anion cu o singură încărcare dă un singur electron.
Conductivitatea electrică specifică a soluțiilor depinde și de temperatură. Această dependență este destul de complicată. Odată cu creșterea temperaturii, viteza ionică crește datorită scăderii vâscozității mediului. În plus, modificarea temperaturii afectează gradul de disociere electrolitică a electrolitului și, astfel, conductivitatea electrică a soluției. O creștere a temperaturii la 1 ° C conduce la o accelerare a mișcării ionilor și, în consecință, la o creștere a conductivității electrice a soluției cu 1,5-2,7%.
Deoarece conductivitatea electrică depinde de mulți factori, nu este posibil, pe baza studiului său, să se tragă concluzii de natură generală. Prin urmare, pentru comoditatea luării în considerare a efectului asupra electroconductivității soluțiilor electroliților asupra concentrației și interacțiunii dintre ionii Lentz, a fost introdus conceptul de conductivitate electrică echivalentă.
Generarea paginii: 0.003 secunde.
Articole similare
Trimiteți-le prietenilor: