Potențialul transmembranar prin definiție este diferența dintre potențialele electrice dintre două faze apoase separate de o membrană. Relația dintre potențialul transmembranar și potențialul de suprafață * i și ♦ g este prezentată grafic în Fig. 7.10, A Din diagrama se observă că diferența de potențial dintre cele două suprafețe ale membranei DF poate fi diferită de Δ * datorită distribuției asimetrice a încărcăturii dintre cele două suprafețe ale bistratificatorului. Orice grup încărcat din interiorul membranei se va deplasa într-un câmp cu potențial DF. A * este numit și potențialul de așteptare, iar această valoare, dacă este posibil, este măsurată printr-o pereche de electrozi.
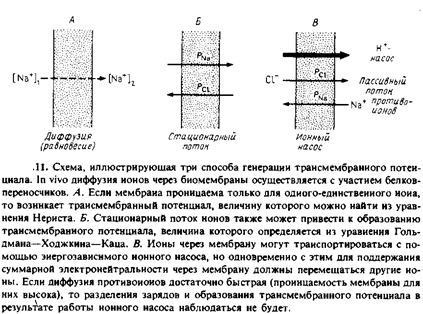
Puteți crea potențialul transmembranar în mai multe moduri. Schematic, acestea sunt arătate în Fig. 7.11.
1. Condiții de echilibru. Dacă membrana este permeabilă la orice ion specific, cum ar fi Na +, și este impermeabilă la alta, atunci acesta poate fi un potențial de difuzie, care este proporțională cu logaritmul raportului dintre concentrațiile ionilor penetrante una și cealaltă parte a membranei. Difuzia ionului prin membrană este însoțită de o separare transmembranară a sarcinilor, iar diferența de potențial creată în acest caz împiedică difuzia ulterioară. Încărcarea care trebuie transferată pe membrană pentru a crea o valoare dată a Aif pe ea poate fi calculată din capacitatea membranei. Pentru a crea A * = 100 mV, este necesar să se transfere aproximativ o încărcătură pe 250 de molecule de fosfolipid. Este clar că densitatea sarcinii de suprafață în acest caz se va schimba foarte ușor.
În echilibru, A * este determinat de ecuația Nernst:
Aceeași ecuație ar trebui utilizată în cazul transferului de ioni cu valența Z. Permeabilitatea biomemembrelor pentru ioni este legată de funcționarea canalelor ionice specifice. Acesta poate fi mărit artificial cu ajutorul purtătorilor de ioni sau ionofori specifici, de exemplu K + -valicinin.
2. Curent ionic de difuzie staționară. Dacă membrana este permeabilă pentru mai mulți ioni, atunci toți vor trece prin ea. În condițiile staționare, datorită diferențelor în coeficienții de permeabilitate pentru diferiți ioni, poate apărea o diferență de potențial transmembranar. Cu alte cuvinte, separarea sarcinilor pe membrană într-o astfel de situație se datorează faptului că unele ioni difuzează prin membrană mai repede decât altele. Ecuația care descrie această situație se numește ecuația Goldman-Hodgkin-Katz și pentru cazul a doi ioni are următoarea formă:
Mișcarea ionilor va continua până la stabilirea echilibrului.
3. Transportul ionic activ. Separarea transmembranară a sarcinilor poate avea loc și prin procese de transport active. Multe enzime catalizează reacțiile asociate cu transferul vectorial al sarcinilor prin bistratificator. Exemplele includ o varietate de pompe de ioni dependente de ATP, de exemplu, Ca2 + -ATPaza sau citocrom c-oxidaza, care este o pompa de protoni. Aici observăm doar că reacțiile catalizate de aceste enzime sunt electrogenice, adică sunt însoțite de transferul de sarcină prin bistratificator. Evident, într-un astfel de sistem trebuie să existe un flux ionic de neutralizare transmembranar. În sistemul prezentat în Fig. 7.11, un astfel de flux este contratransportul pasiv al ionilor CI
care apare atunci când pompa de protoni. Ca și în cazul fluxurilor de ioni pasivi, debitul de contraion va fi mai mic decât viteza procesului activ și, ca rezultat, fluxul total de ion prin bistratificat nu va fi neutru din punct de vedere electric și la membrană va apărea o diferență de potențial N. Dacă permeabilitatea bistratificatorului pentru ionii de neutralizare este suficient de mare, atunci nu va exista nici o separare a sarcinilor. Acest principiu se bazează pe utilizarea ionoforilor pentru eliminarea potențialului electric transmembranar, creat atât pe membranele biologice cât și în sistemele model.
Transformarea genetică a celulelor somatice la mamifere
Culturile celulelor mamifere transformate sunt folosite pentru a produce diferite substanțe. Deși culturile de celule animale, mai ales atunci când sunt cultivate masiv, sunt mult mai puțin economice decât culturile de drojdii bacteriene, ele au un avantaj semnificativ - spori.
Obiecte și metode de cercetare.
În scopul izolării și studierii microorganismelor halofile, au fost prelevate probe de apă dintr-un iaz antropic dintr-o carieră de gips de lac. Marmură (nume popular). Probele de apă din lac au fost investigate. Marmură, și, de asemenea, a fost pus microecosystem imita Lacul. Marmura.
Andrea Cezalpin
Un alt predecesor al lui Harvey este italianul Andrea Cesalpin (1519-1603), profesor de anatomie și botanică la Pisa, ofițerul medical al Papei Clement al VIII-lea. În cărțile sale "Întrebări de predare peripatetică" și "Întrebări medicale", Tzezalpin, cum ar fi Servetus și Colombo, descriu.
Articole similare
Trimiteți-le prietenilor: