Adsorbția electroliților depinde de natura adsorbantului. Ioni care pot polariza sunt adsorbiți numai pe suprafața moleculelor polare sau a ionilor. Cu cât raza ionului adsorbant este mai mare cu aceeași sarcină, cu atât este mai bine să fie adsorbită. Acest lucru se datorează polarizabilității și hidratării mai mari a ionilor mari. Prin capacitatea de a adsorbi, este posibil să se efectueze următoarele serii:
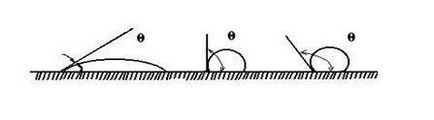
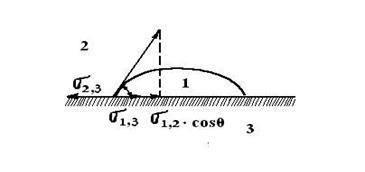
Li + Mg2 + Cl - K + < Schimbarea adsorbției se observă dacă ionul a fost deja adsorbit pe suprafața adsorbantă. Apoi, schimbul poate avea loc între stratul electric dublu al adsorbantului și mediu. Schimbul de ioni are loc în cantități echivalente. Pentru adsorbția schimbului există o serie de caracteristici. 1. Adsorbția schimbului este specifică: numai anumiți ioni sunt capabili să facă schimb. Distingați între adsorbanții acide și bazici. Acid adsorbanții schimbă cationii cu soluții, iar principalele - anioni. Există, de asemenea, adsorbanți amfoterici capabili să facă schimb de ioni din ambele specii. 2. Adsorbția schimbului nu este întotdeauna reversibilă. 3. Adsorbția schimbă mai lent decât adsorbția moleculară. 4. În cazul adsorbției de schimb, pH-ul mediului se poate schimba. adsorbant - H + + Na + + Cl - ® adsorbant - Na + + H + + Cl -; adsorbant + OH - + adsorbant Na + + Cl - ® + Cl - + Na + + OH -. Schimbul de adsorbție are o mare importanță în biologie, agricultură, inginerie. Solul absoarbe ionii de potasiu, amoniu, eliberează ioni de calciu, magneziu, aproape nu absoarbe ioni de clor, nitrați, sulfați. Abilitatea de a absorbi un amestec foarte dispersat de aluminosilicați insolubili ai solului. Rășinile schimbătoare de ioni sunt utilizate pe scară largă pentru purificarea apei, concentrarea soluțiilor. Schimbarea sorbelor se observă la cărbune, deși nu are o polaritate. Pentru a explica acest fapt, AN Frumkin a propus următoarea schemă. Cărbunele adsorbă o moleculă de hidrogen care, la contactul cu adsorbantul, formează un ion de hidrogen: cărbune de cărbune H2® 2-2H + Acest complex este capabil de schimb de ioni: cărbune - H + + Na + + Cl - ® cărbune - Na + + H + + Cl -. Cărbune de cărbune O2® 4 + 2O 2-, Cărbune 2 + O 2 + H 2 O → cărbune 2 + 2 OH -, cărbune + OH - + Na + + Cl - ® cărbune + Cl - + Na + + OH -. Umezirea este determinată de intensitatea interacțiunii dintre moleculele diferitelor substanțe și în acest sens fenomenul este aproape de adsorbție. Când solidul este umezit de lichid, picatura se extinde pe suprafață până când se formează un strat monostrat. Umezirea nu este întotdeauna completă, în acest caz se formează un așa-numit unghi de umectare între picătură și suprafață. Valoarea sa poate fi mai mare sau mai mică de 90 °. După cum se arată în Fig. 4.2. Se acceptă măsurarea unghiului de umectare din partea fazei lichide. Fig. 4.2. Unghi de umezire pentru lichide de natură diferită Umectarea unui solid cu un lichid poate fi considerată ca rezultat al acțiunii forțelor de tensionare de suprafață. Să luăm cazul umezelii incomplete, prezentată în figura 4.3. Circumferința picăturii este interfața dintre cele trei medii: fluid 1, aer 2 și solid 3. Fig. 4.3. Dependența unghiului unghiului la tensiunea superficială la diferite interfețe: 1 - lichid; 2 - aer; 3 - solid Condiția de echilibru este exprimată de ecuația lui Young: Umezirea este însoțită de o scădere a energiei de suprafață Dacă suprafața este în contact cu apa polară și cu o hidrocarbură nepolară, se observă umezeală selectivă. În acest caz, unghiul de contact al umezelii este mai mic de 90 ° și această suprafață se numește hidrofilă. Dacă solul este mai bine udat de un solvent nepolar, atunci pentru apă, unghiul de contact al umezelii este mai mare de 90 ° și suprafața se numește hidrofilă. Se observă umezeală selectivă cu apă atunci când diferența de polaritate dintre apă și solid este mai mică decât cea dintre hidrocarbura nepolară și substanța solidă. Substanțele cu o suprafață hidrofilă sunt cuarț, corund, ghips, oxizi și hidroxizi de metale, celuloză. Umezeala selectivă de către o hidrocarbură nepolară se observă atunci când diferența de polaritate dintre hidrocarbură și solid este mai mică decât cea dintre substanță și apă. Substanțele hidrofobe includ hidrocarburi, sulfuri de metale grele, talc, grafit, sulf. Unghiul limită este măsurat experimental, deși există o serie de dificultăți. Amploarea unghiului este influențată de urmele de contaminare a suprafeței, prezența unui film de oxid, a aerului adsorbit, a rugozității și a condițiilor de formare a suprafeței. Wetting joacă un rol important în procesele tehnologice, de exemplu, în flotație. Metoda se bazează pe utilizarea diferențelor în umectabilitatea particulelor separate cu apă. Luați în considerare comportamentul particulelor hidrofobe și hidrofile mici la interfața apă-aer-apă-ulei. Particulele hidrofilice de pe ambele granițe vor fi atrase în apă și chiuvetă. Particula hidrofobă rămâne la interfață, cu condiția să nu fie foarte grea. Compușii de sulf ai minereurilor sunt mai hidrofobi decât o rocă goală (cuarț). Pentru o mai mare eficiență, aerul (flotarea spumei) este introdus în pastă. Când bulele cresc, ele colectează pe suprafața lor particulele pe care apa formează un unghi mare de contact. Deci, pe suprafața pulpei se formează o spumă mineralizată, care este îndepărtată sub formă de concentrat. Dimensiunea optimă a granulelor în timpul flotării este de 0,15-0,01 mm. Pentru a îmbunătăți eficiența flotării, se folosesc colectoare. Aceștia sunt compuși organici difuși care sunt adsorbiți pe suprafața minerală, astfel încât partea polară se confruntă cu adsorbantul și radicalul este în afară. În acest caz, hidrofobicitatea particulei crește. De multe ori, xantatul este utilizat în acest scop - ROCS2M, unde M este un metal alcalin. Aproape de fenomenul de aderență la udare și adsorbție. Acest fenomen apare când două lichide insolubile reciproc sau un lichid și un corp solid sau două corpuri solide sunt aduse în contact și aderă unul la altul sub acțiunea forțelor intermoleculare. Aderența a două lichide este determinată de ecuația Dupree. Pentru un sistem lichid-solid În plus față de aderență, se deosebește și coeziunea: aderența a două straturi de aceeași substanță.
Articole similare
Trimiteți-le prietenilor: