Titlul lucrării: Structura hemoglobinei
Specializarea: Biologie și genetică
Descriere: Structura hemoglobinei. În molecula de hemoglobină, componenta proteică este o componentă non-proteină globulară fără proteine a hemei. Datorită unei alte legături de coordonare cu atomul de fier, o moleculă de oxigen poate fi atașată pentru a forma oximhemoglobină.
Mărime fișier: 82 KB
Lucrarea a fost descărcată: 53 de persoane.
Grupul de hemoproteine include hemoglobina și derivații săi, mioglobina și enzimele # 150; sistem citocrom, catalază și peroxidază.
Toate cromoproteinele conțin proteine care sunt diferite în compoziție și structură. Componenta non-proteică are o similaritate structurală.
Structura hemoglobinei.
În molecula de hemoglobină, componenta proteică este reprezentată de o globină de proteină, o componentă non-proteică # 150; hem.
Globinul este alcătuit din 4 subunități 2 și 2. Fiecare catenă conține 141 reziduuri de aminoacizi și 146.
În fiecare subunitate există un "buzunar" hidrofob în care este localizată hema.
Hem este o moleculă plană care conține 4 inele de pirol și un atom de fier asociat cu ele:
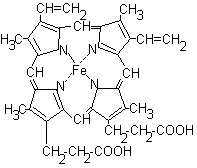
Hem se conectează cu partea proteică (globină) cu legături hidrofobe între inelele de pirol și radicalii de aminoacizi hidrofobi. Între atomul de fier și inelul imidazol al unuia dintre resturile histidină din globină există o legătură de coordonare. Datorită unei alte legături de coordonare cu atomul de fier, o moleculă de oxigen poate fi atașată pentru a forma oximhemoglobină.
Inelele de pirol ale hemei sunt situate în același plan, iar atomul de fier iese din acest plan. Adăugarea de oxigen "îndreaptă" molecula hemei: fier se deplasează în planul inelelor de pirol și aceasta determină o schimbare în conformația proteinei. În molecula de hemoglobină există 4 protomeri, fiecare dintre care conține heme și poate atașa oxigenul. Adăugarea primei molecule de oxigen modifică conformația protonului. Modificarea conformării unui proton modifică conformația protomerilor rămași. Schimbarea în conformația protonilor facilitează atașarea moleculelor de oxigen rămase. Acest fenomen se numește acțiune de cooperare. Afinitatea hemoglobinei pentru a patra moleculă de O2 este de aproximativ 300 de ori mai mare decât în prima moleculă.
Funcția de hemoglobină.
Aceasta constă în legarea și transferul de oxigen din plămâni în țesuturi. Hemoglobina, legată de oxigen, se numește oxihemoglobină.
Derivații de hemoglobină.
Moleculă de hemoglobină are o mare afinitate pentru monoxidul de carbon (II) CO. Aceasta este carboxihemoglobina. Afinitatea CO pentru hemoglobină este de aproximativ 300 de ori mai mare decât cea pentru oxigen. Aceasta indică o toxicitate ridicată a monoxidului de carbon, deci atunci când este necesară intoxicația cu CO, persoana afectată este luată în aer pentru a crește fluxul de oxigen.
Hemoglobina se leagă de CO2, de asemenea, la formarea carbhemoglobinei.
Tipuri de hemoglobine.
Există hemoglobine fiziologice și anormale.
Hemoglobinele fiziologice se formează în diferite stadii ale dezvoltării normale a corpului și anormale # 150; consecința unei secvențe de aminoacizi în globină.
Tipuri fiziologice de hemoglobină.
- primitiv # 150; HbP (include hemoglobine, numite Gover 1 și Gover 2)
- Hemoglobina fetală HbF (hemoglobină fetală).
- Hemoglobina la adulți: Hb A 1. Hb A 2. Hb A 3.
Hb P apare în stadiile incipiente ale dezvoltării embrionare. Primele hemoglobine sunt înlocuite cu HbF. În fazele ulterioare ale dezvoltării fetale, hemoglobinele adulte # 150; Hb A 1. Hb A 2.
În sângele unui adult, aproximativ 95-96% HbA1, 2-3% HbA3, 0,1-0,2% HbF.
Hemoglobina A 1 conține 2 și un lanț. Hemoglobina A 2 # 150; prin 2 și-lanțuri. Hemoglobina F # 150; prin 2 și-lanțuri. Hemoglobina Gover 1 conține 4 lanțuri, Gover 2 # 150; 2 și 2 ale lanțului, pe măsură ce fetusul se înțepenește, lanțurile sunt înlocuite cu - lanțuri.
Tipuri anormale de hemoglobină
Aproximativ 150 de tipuri de hemoglobine mutante au fost descoperite în sângele uman. Hemoglobinele anomale diferă în formă, compoziție chimică, magnitudine de încărcare. Hemoglobinele anomale au fost izolate prin electroforeză și cromatografie. Trecuți prin schimbări ereditare # 150; rezultatul mutației unui singur triplet, care duce la înlocuirea unui aminoacid cu altul (cu proprietăți foarte diferite # 150; exemplu anemie de celule secerătoare # 150; arborele este înlocuit cu un arbore).
Patologia metabolismului hemoglobinei.
Bolile hemoglobinelor (există aproximativ 200) se numesc hemoglobinoză.
Hemoglobinoza este împărțită în:
- hemoglobinopathies # 150; baza este schimbările ereditare în structura unui lanț de hemoglobină normală ("boli moleculare").
- talasemie # 150; încălcarea sintezei unui lanț de hemoglobină.
- Anemie de deficit de fier.
Un exemplu clasic de hemoglobinopatie ereditară este anemia cu secera. Glu în poziția a șasea din lanț este înlocuit cu un arbore. Eritrocitele în condițiile unei presiuni parțiale scăzute a oxigenului au forma unei seceră. O astfel de eliberare de oxigen hemoglobină după convertit într-o formă slab solubil și începe să precipite sub formă de cristaloizi fusiform care deforma și provoca hemoliza masive de celule.
porfirie # 150; un grup de boli cu predispoziție ereditară, care rezultă din blocarea stadiilor inițiale ale sintezei hemiei și însoțite de o creștere a conținutului de porfirine din organism.
Osoblivostі Budova că zhittєdіyalnostі diapozitiv 3 Viznachennya metilarea că zavdan lecție pe care Meta zavdannya viznachaєmo timp de dіtmi: diapozitiv 4 Oznayomitisya special Budova predstavnikіv Klas Pavukopodіbnі; Daty zagalnu caracteristică clasei Pavukopodibni; Viznachiti mіsce pavukopodibnyh u sistemi organichnogo svіtu; Pentru a veni să cunoască autoritățile Pavhutinis în același mod polovannya pavukiv. Lecția Zavdannya: Slide 5 Prostezhiti uskladnennya Budova pavukopodіbnih în porіvnyannі de rakopodіbnimi; Zyasuvati este semnificația pavutini in vita.
Fssen wir einnder n den Händen. Für heute Sind wir Eine Mnnschft SGEN Wir Drei vier und zur rbeit â ???? Ich wünsche euch viel Erfolg während der Stunde. Început cu cea mai bună experiență a lui Lune. Motivarea Ds Them der heutigen Stunde ist Reisen wirâ ???? Die Ziele sind. Den Sitz im Flugzeug wechseln können Denn Sätze trinieren Sehenswürdigkeiten Berlins nennen können rtikel în kkustiv trinieren.
Articole similare
-
Structura anatomiei umane a dinților și cum este aranjată schema
-
Structura articulației, anatomia genunchiului, articulația cotului
Trimiteți-le prietenilor: