Oxidul de vanadiu (V), vanadiu (V) oxid - compus anorganic oxid număr compoziție V 2 O 5. În condiții normale - pulbere de culoare galben-brun, solubil în apă. Substanța este toxică. Ea prezintă proprietăți amfoterice cu o predominanță a celor acide.
Oxidul de vanadiu este cel mai important compus vanadiu. Se folosește la fabricarea catalizatorilor, a sticlei speciale, pigmenților.
Distribuția în natură
Deoarece oxidul de vanadiu formează cu ușurință un hidrat în depozite minerale tocmai în combinație cu apă - căci sunt cunoscuți hidrați Alait V 2 O 5 · H 2 O și V 2 O 5 navahoit · 3H 2 O.
De asemenea, face parte din vanadații naturale: vanadinit 3Pb 3 (VO4) 2 · PbCI2, carnotit K 2 (UO 2) 2 [VO 4] 2 · 3H 2 O, dekluazitu (Zn, Cu) Pb (VO 4) (OH ), FeVO 4 * 2H2O ferrule, puerit BiVO 4 tone.
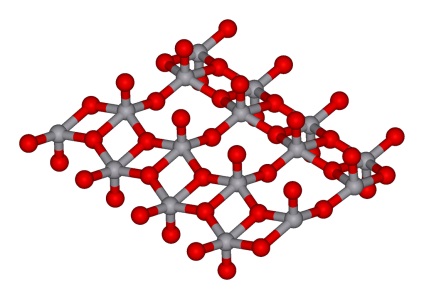
Proprietăți fizice
Oxidul de vanadiu este o pulbere otrăvitoare, inodoră și fără gust. Culoarea sa variază de la galben-portocaliu la brun-brun. Atunci când este răcit dintr-o stare lichidă, acesta cristalizează în ace roș- bic roșii prin proprietăți paramagnetice slabe.
oxid de vanadiu ocupă o poziție intermediară în comparație cu oxizii superioare ale grupelor 4 și 6 ale perioadei sale - TiO 2 și CrO 3. în particular, este de temperatură mai stabil decât oxidul de titan și oxid de crom rezistent.
Principala metodă pentru sinteza oxidului de vanadiu este descompunerea termică a vanadatului de amoniu în aer:
De asemenea, se aplică arderea pulberii de vanadiu într-un curent de oxigen sub presiune:
Metodele mai puțin frecvente sunt descompunerea termică și hidroliza compușilor vanadil:
Proprietăți chimice
Oxidul de vanadiu (V) este un oxid relativ instabil, după încălzire se topește și se descompune pentru a forma oxid de vanadiu (IV):
(impurități V 6 O 13)
Practic nu reacționează cu apa, precipită din soluție ca un hidrat V 2 O 5 · nH 2 O (n = 1, 2, 3).
În interacțiuni, oxidul prezintă proprietăți amfoterice, cu un avantaj semnificativ al proprietăților acide. V 2 O 5 este un oxid mai acid și un oxidant mai puternic decât oxidul de titan (IV) învecinat, dar mai slab decât oxidul de crom (VI).
De asemenea cationi vanadyl soluții puternic acide și anioni ortovanadat în puternic, particulele (VO 3) pot fi de asemenea formate în soluția acidă intermediară -, (HVO 4) 2, (V 3 O9) 3, (V 4 O12) 5 - (V 10 O 28) 6- și altele.
Când este încălzit, oxidul reacționează cu hidrogen, clor, telur, oxid de sulf (IV):
Ultima reacție este o etapă importantă în producerea catalitică a acidului sulfuric.
Vanadiul din oxid este redus doar prin acțiunea calciului, în timp ce cu aluminiu se formează un aliaj V-Al.
Un aliaj important din aliaj de vanadiu este ferovanadiul, care este produs prin reducerea generală a V 2 O 5 și Fe 2 O 3:
toxicitate
Oxidul de vanadiu (V) este periculos. Inhalarea sa irită grav tractul respirator, poate fi însoțită de dificultăți de respirație și de astm, un efect negativ asupra plămânilor. Ingestia unei substanțe este potențial letală, intrat în organism, afectează sistemul nervos central. Contactul cu pielea poate provoca o reacție alergică. Oxidul de vanadiu este clasificat ca un potențial cancerigen.
cerere
oxid de vanadiu este utilizat pe scară largă ca un catalizator pentru cataliza omogenă și heterogenă - în producerea acidului sulfuric, ftalic și anhidridă maleică, acid adipic și acid acrilic. De asemenea, cantități minore sunt folosite pentru a produce acid oxalic și antrachinonă.
Este o componentă de sticlă specială, retardati radiațiile ultraviolete, este de asemenea utilizat la fabricarea pigmenților (SnO galben 2 / V 2 O 5 și ZrO2 albastru / V 2 O5) și atât stratul antistatic în materiale fotografice.
Imagini asemănătoare
Articole similare
Trimiteți-le prietenilor: