VANADIUM OXIDES
VANADIUM OXIDES. Caracteristicile celor mai importante OXIDI VANADIUM în jurul. sunt prezentate în tabel. Cu o creștere a stării de oxidare V, proprietățile acide ale oxizilor sunt îmbunătățite, precum și stabilitatea lor chimică. Pentru mulți, Vanadia Oksida este de aproximativ. o gamă destul de largă de omogenitate este caracteristică (a se vedea tabelul și figura).
Monoxidul de monoxid este insolubil în apă; cu acizii anorganici diluați formează soluții de albastru deschis sau violet ale sărurilor V (II). Un agent reducător puternic. Se obține prin reducerea V2O5 cu hidrogen la 1700 ° C. Hidroxidul V (OH) 2. formată prin acțiunea alcalinilor pe o soluție de săruri V (II), într-o formă individuală nu se obține.
Sesquioxide V2 O3 există în două cristaline. modificări; la - 105 ° Sforma convertită în (tranziție 1,8 kJ / mol) Forma - antiferomagnet, temperatura Neel de 168 K. Apa nu sol. cu săruri anorganice formează săruri V (III). Un agent reducător puternic. Se obține prin reducerea V2O5 cu monoxid de carbon, H2. S, etc. atunci când este încălzit. Aplicată pentru producerea bronzurilor de vanadiu, ca material pentru termistori. Apare în natură sub formă de minerale Karelianite. V Hidroxizi (OH) 3 formate prin acțiunea alcaliilor sau NH4OH în soluții de sare V (III), fără accesul aerului.
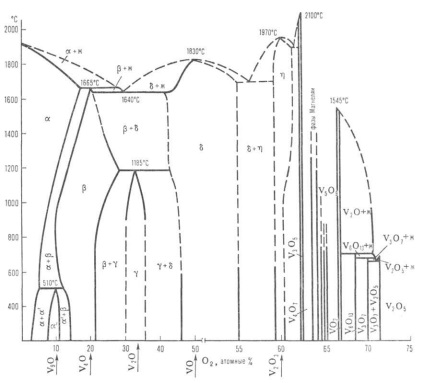
Diagrama stării sistemului vanadiu-oxigen: topitură M; soluție solidă (-O2 la V, pe bază de V9 O; pe bază de V4 O; pe bază V2 O; VO pe bază, pe bază V2 Oz); Liniile punctate indică limitele aproximative ale fazelor.
Pentoxidul trivanadic V3O5 este un antiferromagnet, temperatura lui Neel este de 270 K; la 430 K devine metalic. conductivitate.
Dioxidul VO2 există în două cristaline. modificări; la 68 ° Sforma convertită în (tranziție 3,1 kJ / mol) Forma - antiferomagnet, temperatura Neel de 345 K. Nu este solubil în apă. Higroscopice. Amfoteren: în soluții acide care formează cationi vanadil VO 2+ (soluție transformat albastru pal), alcalină dă vanadați (IV) - sare nu este izolat în liberă izopolivanadievoy de stat (IV) Acid H2 V4 O9. Agent de recuperare. Oxidat în aer. Obtinut prin topirea V2O5 cu acid oxalic, incalzirea fara aer a unui amestec de V2O3 si V2O5. prin oxidarea V2O3. Aplicată în producția de bronzuri de vanadiu, ca material semiconductor pentru termistori, întrerupătoare de elemente de memorie, afișaje etc.
Hidroxid VO (OH) 2 - cristale roz; precipită din soluții la pH> 4. Amfoteren.
Pentaoxid de divanadiu V2O5 peste 700 ° C disociază. Diamagnetic. Tip N-semiconductor; band gap
2,5 eV. Solubilitatea în apă este de 0,35 g / l la 25 ° C; în soluții apoase există sub forma unui acid izopolysodic (V) al compoziției probabile H2 [O (V2O5) 2,5]. În soluțiile acide, formele posibile de existență a V (V) sunt ioni VO2 + și VO3 +. Când aceste soluții sunt încălzite (pH 1-2), se izolează hidrații cu compoziție variabilă V2O5 * xH20. Vanadații (V) se formează în soluții alcaline. Pentru producția de V2 O5 tehnic, consultați Vanadiu. Pur V2O5 este obținut prin descompunerea NH4 VO3 la 400-500 ° C, cu expunerea ulterioară la jetul de O2. hidroliza VOC13. Pentaoxidul este un produs intermediar în producția ferovanadiului, vanadiului, vanadatelor etc. Compusul V; catalizator pentru producerea de H2S04; componente spec. pahare, glazuri și fosforuri de luminiscență roșie. Apare în natură sub formă de schungaită minerală.
PROPRIETĂȚI DE OXIDI DE VANADIU
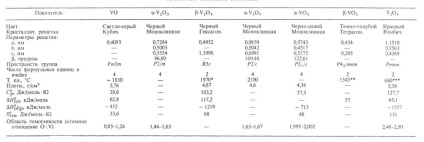
* Punct de fierbere - 3000 ° C (cu diferite). ** Punct de fierbere
Cinci oxizi de vanadiu sunt cunoscuți. formând omoloage. seria Vn O2n-1 (faza Magnelli), unde u = 4-8. Ele sunt cristale negre cu zăbrele triclinice. Aveți metalic. conductivitate la temperaturi scăzute (cu excepția V7O13). Antiferromagnets. M. b. utilizate ca materiale semiconductoare pentru termistori. Vanadiul formează oxizi V3 O7 și V6 O13 - cristale negre zăbrele monoclinic topi incongruent: primul - la 660-680 ° C, cu formarea V6 O13. a doua - la 700-710 ° C cu formarea VO2. VANADIUM OXIDES aproximativ. sunt toxice. Pentru V2O5 MPC 0,1 mg / m3 (fum), 0,5 mg / m3 (praf).
Enciclopedii chimice. Volumul 1 >> La lista articolelor
Articole similare
Trimiteți-le prietenilor: