Compoziția nucleului. S-a stabilit experimental că nucleul atomic constă din protoni și neutroni. Aceste particule se numesc nucleoni.
Protonul (p) are o încărcătură pozitivă e și o masă
unde eu sunt masa unui electron, аемм. Este unitatea de masă atomică. Valoarea masei de protoni este dată în unități energetice, așa cum este obișnuit în fizica nucleară.
Protonul are o rotație s = 1/2 și un moment magnetic intrinsec
unde m este magnetonul nuclear (unitatea în care sunt măsurate momentele magnetice ale nucleonilor):
Magnetonul nuclear este de 1836 de ori mai mic decât magnetonul Bohr, adică momentul magnetic intrinsec al protonului este de 660 de ori mai mic decât momentul magnetic al electronului.
Neutronul (n). Încărcarea sa electrică este zero, iar masa este aproape de masa protonului:
care este de 0,14% sau 2,5 me decât masa protonului.
Unitatea atomică de masă este egală cu 1/12 din masa atomului neutru 12C, adică 1 amu. = 1,66 · 10-24 g sau 931,50 MeV.
Spinul de neutroni este s = 1/2 și, în ciuda absenței unei sarcini electrice, neutronul are un moment magnetic
Semnul minus înseamnă că "direcțiile" spinului și momentul magnetic al neutronului sunt reciproc opuse.
În stare liberă, neutronul este instabil și se descompune spontan, transformându-se într-un proton și emite un electron și o altă particulă, neutrina (v):
Timpul de înjumătățire (timpul pentru care jumătate din numărul inițial de neutroni se descompune) este de aproximativ 12 minute.
Caracteristicile nucleului atomic. Cantitățile principale care caracterizează nucleul atomic sunt încărcătura Z și numărul de masă A al numărului. Numărul Z este egal cu numărul de protoni din nucleu și determină sarcina electrică Ze. Se mai numeste si numarul atomic. Numărul de masă A determină numărul de nucleoni din nucleu. Numărul de neutroni din nucleu
Din punct de vedere simbolistic, aceste caracteristici ale kernel-ului sunt notate după cum urmează:
unde prin X se înțelege simbolul chimic al elementului de care aparține nucleul dat, de exemplu, H, He, U etc.
Atomii specifici cu un număr dat de protoni și neutroni din nucleu sunt denumiți în mod obișnuit nuclide. Nuclidele cu același număr de protoni (adică aparținând unui singur element chimic) se numesc izotopi.
Atomii izotopilor au practic proprietăți fizico-chimice foarte apropiate. Acest lucru se datorează faptului că nucleul influențează structura carcasei de electroni a unui atom, în principal numai cu câmpul său electric. În izotopi, aceste câmpuri sunt aceleași, cu excepția unor cazuri. În mod deosebit, această diferență în cele trei nuclide: H, H și H, ale căror nuclee diferă semnificativ unul de celălalt. Prin urmare, aceste trei nuclide sunt atribuite diferite denumiri - în mod corespunzător, hidrogen obișnuit, deuteriu și tritiu. iar nucleele deuteriului și tritiului sunt deuteron (d) și triton (t).
Pentru diferiți atomi, numărul de izotopi este diferit, printre care există și cele stabile și radioactive.
Dimensiunile nucleelor. Nucleul atomic (ca orice sistem cuantic) nu are o limită clar definită. În experimentele privind împrăștierea electronilor și nucleonilor pe nuclee se stabilește că în fiecare nucleu există o regiune internă în care densitatea # 961; substanța nucleară este aproape constantă;
Stratul de suprafață, unde această densitate scade la zero. Distribuția tipică a concentrației nucleonilor ca o funcție a distanței față de centru
a kernelului, adică, n (r) este prezentată în Fig.
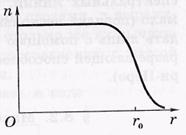
unde r0 este raza nucleului, distanța de la centrul nucleului, la care concentrația nucleonilor scade cu un factor de doi.
În prima aproximare, nucleul poate fi privit ca o rază sferică
unde 1 fm = 10-13 cm Această formulă implică o concluzie importantă: masa nucleului, determinată de numărul de masă A, este proporțională cu volumul lui V. Din moment ce V
A. În consecință, densitatea materiei în toate nucleele este aproximativ aceeași și, după cum arată calculul, este egală cu # 961; 2 × 1014 g / cm3.
Masa și energia legăturii nucleului
Masa nucleului nu este o cantitate aditivă: nu este egală cu suma masei nucleonilor care formează nucleul. Motivul este interacțiunea puternică a nucleonilor din nucleu. Din cauza acestei interacțiuni, pentru o separare completă a nucleului în nucleoni liberi individuali, este necesar să se efectueze o muncă minimă, care determină energia de legare a nucleului Ec. În schimb, atunci când un nucleu este format din nucleoni liberi, această energie este eliberată (sub forma, de exemplu, a radiației electromagnetice).
Pentru a simplifica calculele, conceptul de defect de masă este introdus ca diferență între masa (în amu) și numărul de masă A al nucleului sau nucleonului: = m-A.
unde N = A-Z. În consecință, tabelele nu prezintă masele de nuclide, ci defectele lor de masă.
Energie obligatorie specifică. Aceasta este așa-numita energie obligatorie, care este o medie a unui nucleon, i. E. Eq / A. Această cantitate caracterizează măsura puterii nucleului: cu cât valoarea Ec / A este mai mare. cu atât mai puternic este nucleul.
Energia de legare a electronilor în atomi este de ordinul a 10 eV, care este neglijabilă cu magnitudinea energiei de legare a nucleului.
Energia obligatorie specifică Ec / A depinde de numărul de masă A. Graficul din dependența corespunzătoare este prezentat în figură.
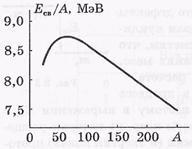
Energia de legare specifică a nucleelor este aproape independentă
din numărul de masă A și este egal cu aproximativ 8 MeV. O dependență aproximativă a energiei obligatorii specifice pe A înseamnă că forțele nucleare au proprietatea de saturație. Se compune din faptul că fiecare nucleon interacționează numai cu un număr limitat de nucleoni vecini.
De asemenea, rezultă că forțele nucleare acționează pe termen scurt cu o rază de ordinul distanței medii dintre nucleonii din nucleu (
Cele mai stabile sunt nucleele cu numere de masă A
50 ÷ 60, adică elemente de la Cr la Zn.
Articole similare
Trimiteți-le prietenilor: