DEPARTAMENTUL DE OBSTETRICĂ ȘI GINECOLOGIE
Încetarea sângerării după afectarea traumatică a vaselor de sânge se numește hemostază.
Există patru faze ale hemostazei:
· Prima fază este reducerea vasului deteriorat. În același timp, aportul de sânge în regiunea distală de la rănire este redus.
· A doua fază este formarea unui dop de trombocite sau a unui cheag alb în locul leziunii. Colagenul prezent în locul leziunii servește drept centru de legare pentru plachete; în cel de-al doilea, ca urmare a legării, structura lor internă este distrusă, iar tromboxanul și ADP sunt eliberate. Acestea, la rândul lor, induc atașarea de noi trombocite și astfel se formează un opritor temporar slăbit. Durata acestei faze a hemostazei este determinată de durata sângerării.
· A treia fază - formarea unui cheag de sânge roșu (cheag de sânge).
· Faza a patra - dizolvarea parțială sau completă a cheagului.
Există trei tipuri de trombi sau cheaguri:
Tromboul alb (primul tip) este format din trombocite și fibrină; există puține eritrocite în el. Se formează în locuri de vătămare sau pe un perete al vasului modificat patologic, în condiții de viteză ridicată a fluxului sanguin (în artere).
Cel de-al doilea tip de tromb este diseminarea depozitelor de fibrină în vase foarte mici (capilare).
· Al treilea tip de trombus - cheag de sânge roșu - constă în celule roșii și fibrină. Morfologia cheagului de sânge roșu este similară cu morfologia cheagurilor formate în eprubeta. cheaguri sanguine rosii sunt formate in vivo în zone ale fluxului sanguin lent în absența modificărilor patologice ale peretelui vasului la locul de deteriorare sau modificate peretelui vasului după inițierea dop de plachete.
- Inițierea formării de trombus ca răspuns la leziunea tisulară se realizează pe calea de coagulare externă.
- Inițierea formării unui cheag de sânge roșu în zona fluxului sanguin întârziat sau pe un perete vascular anormal în absența afectării țesuturilor are loc de-a lungul modului intern de coagulare.
- Căile externe și interne ale coagulării se termină într-o cale finală comună. În această etapă, protrombina se transformă în transformarea fibrinogenului în trombină și catalizată de trombină în cheagul de fibrină.
Tabelul 1. Sistemul de numerotare a factorilor de coagulare.
Numerele nu reflectă succesiunea factorilor
Transformarea fibrinogenului în fibrină catalizată de trombină
Fibrinogenul (factor I. A se vedea figura 1 și tabelul 1, ...) - este o glicoproteină plasmatică solubilă sintetizată în ficat, lungimea sa molecula este de 46 nm, masa molara 340000. moleculă compusă din șase lanțuri polipeptidice (două A # 945; - lanțuri, două B # 946; - lanțuri și două # 947; lant). Structura fibrinogenului - A # 945; 2 B # 946; # 947; 2. B # 946; - și # 947; - lanțurile conțin oligozaharide complexe asociate cu resturile Asn. Capetele moleculelor de fibrinogen au o încărcătură negativă puternică; acest lucru se datorează prezenței unui număr mare de reziduuri de aspartat și glutamat în regiunea A a catenei A # 945; și în regiunea B a regiunii lanțului B # 946; (Figura 1). În plus, regiunea B a lanțului B. # 946; conține un reziduu încărcat în mod neobișnuit negativ de tirosin-O-sulfat. încărcat negativ a moleculelor de fibrinogen nu promovează numai ultima solubilitate în apă, ele împing capetele altor molecule de fibrinogen, ceea ce împiedică agregarea acestora din urmă.
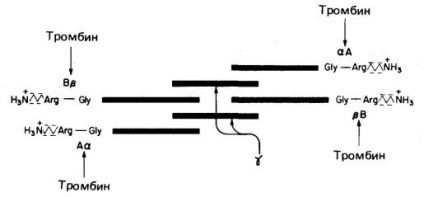
Fig. 1. Reprezentarea schematică a fibrinogenului, structura lui (A # 945; B # 946; # 947;) 2. sarcinile încărcate, punctele de clivare a trombinei (săgeți) a patru legături peptide Arg-Gly.
Trombina este o serin protează cu un mol. m 3400, constând din două lanțuri de polipeptide. Trombina hidrolizează patru legături peptide Arg-Gly în fibrinogen (Figura 1). Dintre cele patru legături, două se conectează la regiuni A și # 945;. iar celelalte două sunt regiuni B și B # 946; în circuitele A # 945; și B # 946; respectiv. Fragmentele A și B scoase din molecula de fibrinogen sunt fibrinopeptide încărcate negativ. ca rezultat, un monomer de fibrină având o structură ( # 945; # 946; # 947; ) 2. Lungi monomeri de fibrină insolubilă spontan asociază în structura zigzag regulate; ca rezultat, se formează un cheag fibrin polimeric insolubil. Aceasta captura celule sanguine roșii, trombocite și alte componente sanguine, rezultând într-un trombus roșu sau trombus alb (plug de trombocite). Într-un stadiu incipient al cheagului de fibrină este formarea destul de neconsolidate, deține doar sistemul nekovalentnosvyazannoy monomeri de fibrină insolubilă.
Funcția trombinei în plus față de conversia fibrinogenului în fibrină este transformarea factorului XIII în forma sa activă (XIIIa). Factorul XIIIa (transglutaminază) "reticulează" monomerii de fibrină prin formarea unei legături specifice de izopeptide între # 947; o grupare carboxamidă de glutamină și # 949; amino a lizinei (Figura 2). Această stabilizare a cheagului de fibrină favorizează retragerea acestuia. care pot fi observate in vitro. Creșterea sângerării observată la pacienții cu deficiență ereditară de factor XIII. se explică prin incapacitatea de a forma un cheag fibrin stabil.
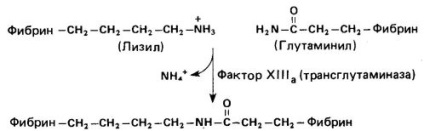
Fig. 2. Legarea încrucișată a moleculelor de fibrină sub acțiunea factorului activat XIII.
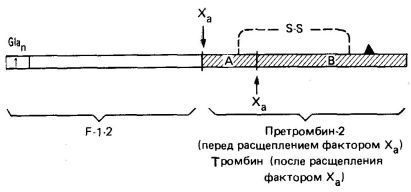
Fig. 3. Structura schematică a protrombinei, N-end-stânga; Regiunea I conține toate reziduurile de Gla. Locurile de clivaj sunt prezentate cu factorul Xa și denumirea produselor de clivare. Localizarea reziduului de serină activă catalitic este indicată de ▲. Lanțurile A și B ale trombinei active (umbrite) sunt ținute împreună prin puntea disulfidică.
Activarea protrombinei se produce pe trombocite; fosfolipidele de trombocite anionice sunt implicate în acest proces. ioni de Ca2 +. factorii Va și Xa.
Fosfolipidele, care sunt pe partea interioară a membranei plasmatice a plachetelor, expuse ca urmare a induse de colagen degranulării plachetelor și distrugere. Aceste fosfolipide leagă ionii de Ca2 + și protrombina (aceasta din urmă, de-a lungul regiunii N-terminale care conține resturi Gla). Plachetele conțin, de asemenea, factor V, care în forma activată (Va) se leagă la receptorii specifici de pe membrana plachetară (Figura 4). Factorul Va servește ca receptor pentru factorul Xa, care la rândul său leagă protrombina în regiunea F -1-2 (Figura 3). Factorul X este, de asemenea, o proteină serinică, scindează molecula de protrombină inactivă catalitic în regiunile indicate în Fig. 3. În acest caz, partea N-terminală a protrombinei este eliberată. Ca urmare a scindării trombinei prin factorul X, se formează polipeptide ale trombinei A și B legate printr-o punte disulfidică.
Legarea fosfolipidului prin ioni de Ca2 + la resturile de protrombină Gla îmbunătățește activarea ultimelor 50-100 de ori. Acest lucru se pare că se datorează creării unei concentrații locale ridicate de protrombină și factorul Xa (Figura 4). Factorul Va determină o creștere a activării protrombinei cu aproximativ 350 de ori, de asemenea datorită creșterii concentrației locale a factorului Xa.
Factorul Va. formată prin acțiunea trombinei din factorul V. ulterior, aceeași trombină și este inactivată, astfel că procesul de activare a protrombinei în trombină este limitat.
Protrombina poate fi activată prin stafilocoagulază ca urmare a modificărilor conformaționale.
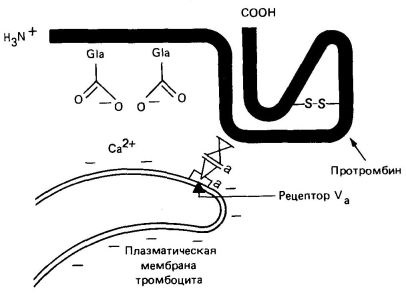
Fig. 4. Schema factorilor de legare Va. Xa. ioni de Ca2 + și de protrombină cu o membrană plasmatică a trombocitelor.
Activarea factorului X
Calea externă de formare a factorului Xa
Pauza conexiunii Arg-Ile. și astfel conversia factorului X la factorul Xa, este efectuată în comun și a factorului VII și factor tisular pe calea externă. Factorul VII a funcționează numai pe calea externă, care se transformă rapid după deteriorarea țesutului. Precursorul factorului Vila - factorul VII (una Gla -Cu glicoproteine) - este sintetizată în ficat și poate fi activat de trombina sau factorul Xa. Factorul VII este un zymogen, dar are o activitate endogenă relativ înaltă. Factorul tisular accelerând factori de acțiune VII sau VIIa pe X. factor conținut într-o cantitate mai mare in placenta, plamani si creier.
În 1 ml de plasmă se află aproximativ 3 mg de fibrinogen și numai 0,01 mg de factor X. Aceasta înseamnă că amplificarea trebuie să aibă loc în sistemul de coagulare. Într-adevăr, conversia factorului X în X a este un proces autocatalitic care poate fi considerat ca o amplificare. În grupul de reacții considerate, nu este ușor să înțelegem ce este primar - "pui sau ou"; în acest caz, factorul IIa (trombina) sau factorul Xa (figura 5).
Modul intern de formare a factorului X a
cale interioară a factorului X și începe cu interacțiunea în prekalikreină vivo. kininogen cu greutate moleculară mare. factorii XII și XI pe suprafața de activare este probabil colagen (fig. 6). Suprafața de activare a căii interne în experimente in vitro este sticlă și caolin. Interacțiunea factorului XII cu suprafața de activare făcându-l mai accesibil kalikreina atac proteolitice. Ca rezultat al kalikreina format II Factor Xa, care la rândul său induce o tranziție prekalikreină în kalikreina. Astfel, există o activare reciprocă. Factor II și X eliberează bradikinina de kininogen greutate moleculară mare și activează factorul X XI și I. I și Factorul X prin două reacții succesive activează factorul IX (Gla -Cu zimogen). I Factor Xa în prezența ionilor Ca2 + și fosfolipide acide activează lent factorul X; Activarea are loc prin scindarea aceeași conexiune Arg - Il E, care clivează Factorul Vila pe calea exterioară. Rata factorului X factor de activare a Xa I a crescut de 500 de ori în prezența factorului VIII (sau Vllla). Pentru a activa factorul VIII. aparent, este necesară o cantitate mică de trombină. Factorul VIII nu este o protează; probabil, este un receptor pentru factorul IX și scindarea Arg ultima comunicare - Il e în factorul X. calea intrinsecă a coagulării sângelui - un proces lent, deoarece un număr mare de factori sunt implicați în ea. Împreună, ele formează un mecanism în cascadă care generează Factor Xa (vezi Fig. 6).
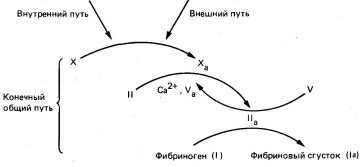
Fig. 5. Interrelarea căii comune interne, externe și finale în procesul de coagulare a sângelui.
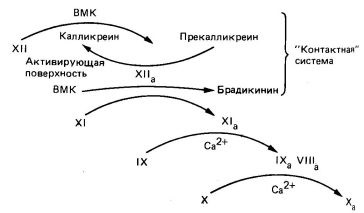
Fig. 6. Modul intern de activare a factorului X în X a. VMK - kininogen cu greutate moleculară mare.
Există o serie de boli umane ereditare datorită insuficienței diferitelor componente ale sistemului de coagulare. Deficitul cel mai frecvent observat de factor VIII. determinarea hemofiliei A (gena corespunzătoare este localizată în cel de-al 10-lea cromozom uman). Această boală a jucat un rol semnificativ în istoria dinastiei regale din Europa.
Plasma normală este caracterizată prin mai multe tipuri de activitate antitrombină. O mică contribuție la aceasta este făcută de către # 945; 1-antitripsină. Pe cota specifică # 945; 2-globulina reprezintă aproximativ 25% din toată activitatea antitrombinei din plasmă. Formează un complex ireversibil cu trombină și alte proteaze, împiedicând astfel legarea acestor enzime la substraturile lor naturale. # 945; 2-globulina este considerată ca; # 945; 2-inhibitor al plasminelor, deoarece inactivează de asemenea plasmina, care este o serin protează cu activitate fibrinolitică.
Cea mai mare activitate antitrombină este inerentă antitrombinei III. Antitrombina III are o activitate endogenă redusă și este puternic activată în prezența heparinei, care are o încărcătură negativă mare. Heparina pare să se lege la un anumit sit cationic al antitrombinei III. provocând o modificare conformațională în molecula sa. Ca urmare a acestei schimbări, antitrombina III dobândește capacitatea de a se lega de toate proteinele serice, incluzând tripsina, chymotripsina și plasmina. În sistemul de coagulare a sângelui, antitrombina III inhibă activitatea trombinei, factorii Iha, Xa, XIa și XIIa. La pacienții cu deficiență ereditară de antitrombină, se observă o tendință de formare a cheagurilor. Prin urmare, se poate concluziona că antitrombina exercită funcții fiziologice și că, în mod normal, procesul de coagulare a sângelui la om este un sistem foarte dinamic.
Heparina este adesea folosită în practica clinică ca medicament care previne coagularea sângelui. Principalul factor care determină activitatea anticoagulantă a heparinei este activarea antitrombinei III. care, la rândul său, inhibă proteinele serice examinate mai sus. Se știe că o mică cantitate de heparină este localizată pe pereții vaselor, ca urmare, activarea căii interne este redusă. Activitatea anticoagulantă a heparinei poate fi suprimată puternic de polipeptide cationice (de exemplu, protamină). Astfel de polipeptide concurează cu situsurile cationice ale antitrombinei III pentru legarea la heparina polianionică.
Preparatele din grupul cu cumarină inhibă cartilarea dependentă de vitamina-K a reziduurilor Glu. conducând la formarea Gla în partea N-terminală a moleculei de factor II. VII. IX și X. Toți acești factori sunt sintetizați în ficat și formarea resturilor Gla este necesară pentru maturarea lor și, prin urmare, pentru funcționarea normală a căilor interne de coagulare internă, externă și generală. Se pare că preparatele de cumarină inhibă reducerea derivaților de chinonă ai vitaminei K în forme de hidrochinonă active. Introducerea vitaminei K elimină blocul cauzat de cumarină și asigură maturarea în ficat a factorilor de coagulare dependenți de Gla. Tratamentul acțiunii cumarinei cu vitamina K se observă numai după 12-24 ore; Tratamentul activității protivovertativayuschey a heparinei cu protamină are loc aproape imediat; această diferență se datorează naturii mecanismelor antagoniste.
Există dovezi convingătoare că sistemul de coagulare a sângelui este în mod normal într-un echilibru dinamic, în care sunt formate în mod constant cheaguri de fibrină și apoi se dizolvă. Plasmina este o serin protează capabilă să hidrolizeze fibrinogenul și fibrina, factorii V și VIII. factorii de complement și diferiții hormoni polipeptidici. În mod normal, plasmina este conținută în plasmă sub forma unei proenzime inactive (plasminogen). În cele mai multe țesuturi ale corpului există activatori de plasminogen de diferite tipuri. Activatorul de țesut al plasminogenului este o serină protează care este inactivă din punct de vedere catalitic în absența contactului cu fibrina. Fiind în contact cu fibrina, activatorul de plasminogen este capabil să creeze molecula de plasminogen pentru a forma plasmina. Când plasmina hidrolizează fibrina, activatorul de plasminogen își pierde activitatea și proteoliza se descompune. Astfel, se asigură reglarea eficientă a procesului de fibrinoliză. Este foarte promițătoare să se utilizeze în scopuri terapeutice un activator de plasminogen tisular (TAP), obținut prin inginerie genetică. TAP promovează restaurarea permeabilității arterelor coronare, reducând astfel leziunea miocardică care apare cu tromboza coronariană acută. Un alt activator al plasminogenului - enzima proteolitice urokinază - este conținut în urină. Urokinaza este, de asemenea, o proteinază serină; acesta poate activa plasminogenul prin împărțirea în două locuri.
Plasminogenul precipită în mod normal cu fibrină și, prin urmare, face parte din cheagul de fibrină. Plasmina rezultată scindează moleculele de fibrină în fragmente solubile și cheagul dispare (se dizolvă). Cheagurile de fibrină cu legături încrucișate sunt mai dificil de dizolvat de plasmină.
Concentrația activatorilor de plasminogen crește într-o serie de boli, inclusiv unele forme de cancer și șoc. Activitatea anti-plasmină, datorită # 945; 1-antitripsină și # 945; 2 inhibitor al plasminelor, poate scădea cu ciroza hepatică. Unele produse bacteriene, de exemplu streptokinaza, sunt capabile să activeze plasminogenul fără a-și împărți molecula și pot fi responsabile pentru hemoragii difuze, uneori observate la pacienții cu infecții bacteriene diseminate.
Articole similare
Trimiteți-le prietenilor: