Sarcina principală a biochimiei este de a realiza o înțelegere completă la nivel molecular a naturii tuturor proceselor chimice asociate cu activitatea celulelor. Pentru a rezolva această problemă, este necesar să selectați din celule numeroși compuși care sunt acolo, să le determinați structura și să vă stabiliți funcțiile.
1.1.2. Între biochimie și medicină există o comunicare largă bidirecțională. Datorită cercetării biochimice, a fost posibil să răspundem la multe întrebări legate de dezvoltarea bolilor. De exemplu:
Un studiu al acțiunii toxina produsă de agentul patogen de holeră, a ajutat la elucidarea mecanismelor de apariție a simptomelor clinice (diaree, deshidratare) si dezvoltarea de tratamente pentru aceasta boala.
Prezența țânțarilor - vectori de patogeni ai malariei - sisteme biochimice pentru a asigura imunitatea lor la insecticide, este luată în considerare în elaborarea măsurilor de control al malariei.
Un studiu al dietei din Groenlanda eschimoșii, care consumă cantități mari de ulei de pește bogat în acizi grași polinesaturați de unii, și rareori care suferă de ateroscleroză, m-au determinat să se gândească la utilizarea acestor acizi grași pentru a reduce conținutul de colesterol în plasma sanguină.
Pe de altă parte, studiul cauzelor și evoluției anumitor boli a dus la crearea unor noi domenii de biochimie:
observațiile medicului englez Archibald Garrod pentru pacienții care suferă de tulburări metabolice congenitale au stimulat studiul căilor metabolice, a căror încălcare apare în astfel de condiții.
studiul proceselor biochimice la pacientii cu hipercolesterolemie familiala, care conduc la dezvoltarea aterosclerozei severe la o vârstă fragedă, a contribuit la obținerea de date cu privire la receptorii celulari și mecanismele de absorbție a colesterolului de către celule.
Un studiu intensiv al metabolismului în celulele tumorale maligne a provocat un interes în mecanismele moleculare de control al creșterii și înmulțirii celulelor.
În procesul de studiere a cursului nostru vor fi prezentate alte exemple de interacțiune strânsă între biochimie și medicină.
1.2.1. Principalul obiect de studiu în cursul nostru este metabolismul - agregatul tuturor reacțiilor chimice care apar în celulă. Toate aceste reacții, cu o mică excepție, sunt catalizate de proteine specializate, enzime. Înțelegerea mecanismelor cursului reacțiilor metabolice este imposibilă fără cunoașterea caracteristicilor funcționării enzimelor, a mecanismelor de reglementare a acestora. Proprietățile și mecanismul de acțiune al enzimelor se datorează naturii lor chimice. Prin urmare, studiul cursului de biochimie începe, în mod tradițional, cu o analiză a structurii și funcției proteinelor.
1.2.2. După cum se știe din cursul chimiei bioorganice, toate proteinele sunt construite din monomeri - a-aminoacizi având formula generală:
,
unde R este un radical sau un lanț lateral.
Pentru aminoacizii care alcătuiesc proteinele, următoarele proprietăți comune sunt caracteristice:
toate sunt a-aminoacizi. În organism există, de asemenea, aminoacizi cu un aranjament diferit al radicalului, dar nu fac parte din proteine;
deoarece toți aminoacizii (cu excepția glicinei) atom α-carbon legat la patru substituenți diferiți, acest atom este asimetric și aminoacizi au activitate optică (capacitatea de a roti planul luminii polarizate într-o direcție sau alta);
aminoacizii care conțin un atom de carbon asimetric aparțin seriei L-stereochimice. Nu există D-izomeri ai aminoacizilor în proteinele organismului;
în soluții apoase neutre, aminoacizii sunt sub formă de ioni bipolari (ioni de zwitter) și prezintă atât proprietăți acide, cât și bazice.
Proprietățile individuale ale fiecăruia dintre aminoacizii sunt determinate de structura radicalului său. Repetați formulele de aminoacizi proteici 20 (Figura 1.1) și abrevierile acestora (Tabelul 1.1).
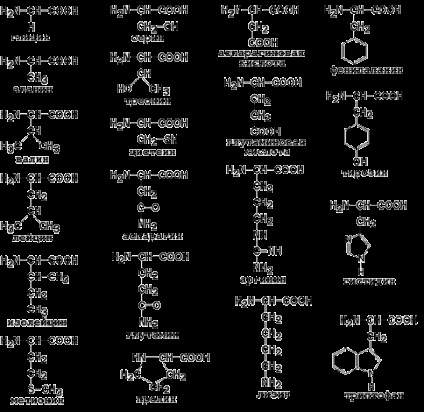
Figura 1.1. Formule de aminoacizi.
1.2.3. Aminoacizii proteinei pot fi clasificați pe baza polarității radicalilor lor. Acestea pot fi împărțite în următoarele grupuri: (Figura 1.2).
1.3.1. Două molecule de aminoacizi identici sau diferiți pot fi legați covalent unul de celălalt printr-o legătură amidică substituită, care se numește o legătură peptidică. Legătura peptidică se formează prin scindarea grupării -OH de la a-carboxilul unui aminoacid și a atomului de hidrogen din gruparea a-amino a unui alt aminoacid. Unitatea peptidică are o structură rigidă. Toți cei patru atomi sunt localizați într-un plan, iar hidrogenul grupării NH ocupă o transpunere în raport cu oxigenul grupării carbonil. Legătura dintre atomii de carbon și azot este parțial o legătură dublă, iar rotirea în jurul acestei conexiuni este dificilă. În același timp, pe ambele părți ale unității peptidice, există un grad ridicat de libertate de rotație în raport cu legăturile C-Ca și Ca-N.
1.3.2. Aminoacizii sunt capabili să formeze lanțuri de polipeptide cu ajutorul legăturilor peptidice. Secvența aminoacizilor din lanțul polipeptidic se numește structura primară a proteinei. Peptidele diferă de proteine printr-un număr mic de unități de aminoacizi. Astfel, produsul interacțiunii a doi aminoacizi care conțin o legătură peptidică se numește dipeptidă, trei aminoacizi sunt tripeptide, patru sunt tetrapeptide etc. În organismul uman, peptidele se formează, de regulă, prin hidroliza parțială a proteinelor. Multe dintre aceste peptide au o activitate biologică ridicată, de exemplu, vasopresină, oxitocină, bradikinină, thyreoliberină. enkefalinelor.
Unitățile de aminoacizi ale peptidei sau proteinei sunt numite reziduuri de aminoacizi. Reziduul de aminoacid care conține gruparea α-amino liberă este denumit N-terminal, iar restul având o grupare α-carboxil liberă este C-terminal. Formulele structurale ale peptidelor sunt înregistrate și citite de la capătul N-terminal. Toate resturile de aminoacizi care alcătuiesc polipeptida (cu excepția C-terminalului) obțin în final -il în loc de -in. Pentru a desemna aminoacizii în lanțurile de polipeptide, în literatura internă se folosesc abrevieri de trei litere (Tabelul 1.1).

Figura 1. Exemplu de peptidă.
1.3.3. Aflați cum să scrieți formulele structurale ale peptidelor. Amintiți-vă că peptidele sunt scrise și citite de la capătul N-terminal. În primul rând, structura coloanei vertebrale a peptidei este scrisă, de exemplu:
pentru tetrapeptid și așa mai departe.
Apoi, radicalii laterali se adaugă la atomii de carbon, de exemplu, tripeptida fenilefalenei se înregistrează după cum urmează:
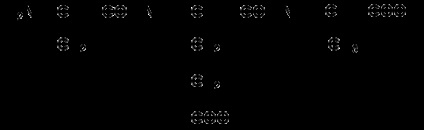
Anumite dificultăți sunt cauzate de scrierea peptidelor care conțin resturi de prolină. În acest caz, trebuie avut în vedere faptul că radicalul prolin este atașat nu numai la atomul de carbon α, ci înlocuiește și atomul de hidrogen din grupa α-amino. De exemplu, peptida tre-gly-pro este înregistrată după cum urmează:
1.3.4. Învață să dai nume peptidelor. Nu uitați că toate resturile de aminoacizi care sunt parte a polipeptidei (cu excepția C-terminal), au se încheie -in-il în loc (Tabelul 1.1) Rețineți că numele de reziduuri ale anumitor aminoacizi sunt formate nu ca regulă generală.
1.3.1. Două molecule de aminoacizi identici sau diferiți pot fi legați covalent unul de celălalt printr-o legătură amidică substituită, care se numește o legătură peptidică. Legătura peptidică se formează prin scindarea grupării -OH de la a-carboxilul unui aminoacid și a atomului de hidrogen din gruparea a-amino a unui alt aminoacid. Unitatea peptidică are o structură rigidă. Toți cei patru atomi sunt localizați într-un plan, iar hidrogenul grupării NH ocupă o transpunere în raport cu oxigenul grupării carbonil. Legătura dintre atomii de carbon și azot este parțial o legătură dublă, iar rotirea în jurul acestei conexiuni este dificilă. În același timp, pe ambele părți ale unității peptidice, există un grad ridicat de libertate de rotație în raport cu legăturile C-Ca și Ca-N.
1.3.2. Aminoacizii sunt capabili să formeze lanțuri de polipeptide cu ajutorul legăturilor peptidice. Secvența aminoacizilor din lanțul polipeptidic se numește structura primară a proteinei. Peptidele diferă de proteine printr-un număr mic de unități de aminoacizi. Astfel, produsul interacțiunii a doi aminoacizi care conțin o legătură peptidică se numește dipeptidă, trei aminoacizi sunt tripeptide, patru sunt tetrapeptide etc. În organismul uman, peptidele se formează, de regulă, prin hidroliza parțială a proteinelor. Multe dintre aceste peptide au o activitate biologică ridicată, de exemplu, vasopresină, oxitocină, bradikinină, tireolicină. enkefalinelor.
Unitățile de aminoacizi ale peptidei sau proteinei sunt numite reziduuri de aminoacizi. Reziduul de aminoacid care conține gruparea α-amino liberă este denumit N-terminal, iar restul având o grupare α-carboxil liberă este C-terminal. Formulele structurale ale peptidelor sunt înregistrate și citite de la capătul N-terminal. Toate resturile de aminoacizi care alcătuiesc polipeptida (cu excepția C-terminalului) obțin în final -il în loc de -in. Pentru a desemna aminoacizii în lanțurile de polipeptide, în literatura internă se folosesc abrevieri de trei litere (Tabelul 1.1).

Figura 1. Exemplu de peptidă.
1.3.3. Aflați cum să scrieți formulele structurale ale peptidelor. Amintiți-vă că peptidele sunt scrise și citite de la capătul N-terminal. În primul rând, structura coloanei vertebrale a peptidei este scrisă, de exemplu:
pentru tetrapeptid și așa mai departe.
Apoi, radicalii laterali se adaugă la atomii de carbon, de exemplu, tripeptida fenilefalenei se înregistrează după cum urmează:
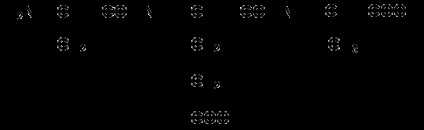
Anumite dificultăți sunt cauzate de scrierea peptidelor care conțin resturi de prolină. În acest caz, trebuie avut în vedere faptul că radicalul prolin este atașat nu numai la atomul de carbon α, ci înlocuiește și atomul de hidrogen din grupa α-amino. De exemplu, peptida tre-gly-pro este înregistrată după cum urmează:
1.3.4. Învață să dai nume peptidelor. Nu uitați că toate resturile de aminoacizi care sunt parte a polipeptidei (cu excepția C-terminal), au se încheie -in-il în loc (Tabelul 1.1) Rețineți că numele de reziduuri ale anumitor aminoacizi sunt formate nu ca regulă generală.
1. Un amestec de aminoacizi conținând triptofan și lizină. a fost separat prin cromatografie pe hârtie. Care dintre acești aminoacizi după manifestarea cromatogramei va fi cel mai îndepărtat de punctul de pornire?
2. La hidroliza parțială a peptidelor proteice au fost obținute: a) tir-ser-arg-asp și b) met-pro-asp-lei. Care dintre aceste peptide se dizolvă mai bine în apă?
3. În care mediu (acid, alcalin, neutru) este punctul izoelectric al peptidelor: a) ala-val-lys-fen; b) cis-glu-tri-
4. În ce direcție (la catod, la anod) se va muta în câmpul electric la peptide cu pH 7,0: a) arg-gli-ala-val; b) leu-asp-glu-tir;
5. O peptidă conținând 9 resturi de aminoacizi a fost hidrolizată în două moduri diferite. Următoarele seturi de peptide au fost găsite în hidrolizate:
pro-TRE-GIS; Asp-Ser-cis; Tyr-Gly-Arg;
GIS-fotografiere; cis-Pro-Thr; Gly-Arg; Asp-Ser.
Se determină secvența de aminoacizi a peptidei părinte.
1.5.2. Standarde de decizie.
1. Tricopantul va fi mai îndepărtat de punctul de plecare, deoarece acest aminoacid conține un radical hidrofob și este mai bine solubil în faza mobilă cu solvent organic - prin cromatografie pe hârtie (vezi punctul 1.2).
2. în peptida tir-ser-arg-asp, toate cele patru reziduuri de aminoacizi sunt hidrofile; peptida met-pro-asp-lei conține un rest hidrofil și două resturi de aminoacizi hidrofobi. Prin urmare, prima peptidă este mai bine solubilă în apă (vezi punctul 1.4).
3. a) Peptida ala-val-lys-fen conține un radical amino acid încărcat pozitiv; în consecință, punctul izoelectric al peptidei este în mediul alcalin;
b) Cis-glu-tri-met peptida conține un radical de aminoacizi încărcați negativ, astfel încât punctul izoelectric al acestei peptide este într-un mediu acid (vezi 1.4).
4. a) Compoziția peptidei arg-gli-ala-val conține un radical încărcat pozitiv, prin urmare, într-un câmp electric la pH 7,0, această peptidă se va deplasa la catod;
b) peptida leu-asp-glutar este constituită din două resturi de aminoacizi încărcate negativ. Astfel, această peptidă într-un câmp electric se va deplasa la anod (vezi 1.4).
5. Pentru a rezolva această problemă, în primul set de peptide, este necesar să se găsească acelea în care secvența de aminoacizi coincide parțial cu secvența aminoacizilor din peptidele din al doilea grup. Acest lucru ne permite să determinăm care legături peptidice din peptida părinte au fost hidrolizate. Astfel, în primul grup există peptide pro-tre-gis și asp-ser-cis; în al doilea grup - peptida cis-pro-tre. În consecință, în peptida mamă există o legătură între resturile cis și pro și conține fragmentul asp-sery-cis-pro-treg. În cel de-al doilea set de peptide, există o dipeptidă gis-tir, în primul caz acești aminoacizi fac parte din tripeptide diferite. Prin urmare, în peptida inițială a existat o legătură între acești aminoacizi și avea următoarea structură: asp-sery-cis-pro-tre-gis-tiir-gli-arg.
Articole similare
Trimiteți-le prietenilor: