Masă moleculară de etilenă
Etilena (etenă) - o substanță complexă de natură organică, este strămoșul seriei omoloage clasei alchenelor (hidrocarburi nesaturate / nesaturate, cu o dublă legătură).
Structura moleculei este prezentată în Fig. 1. În condiții obișnuite de etilenă, este un gaz inflamabil incolor, cu un miros slab. Densitate - 1,178 kg / m 3. Puțin solubil în apă.
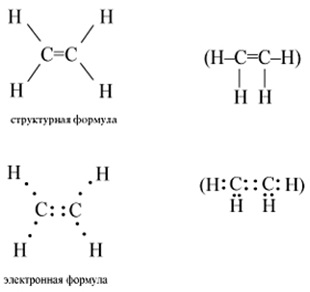
Fig. 1. Structura moleculei de etilenă.
Formula brută de etilenă este C2H4. După cum se știe, masa moleculară a unei molecule este egală cu suma masei atomice relative a atomilor care alcătuiesc molecula (valorile masei atomice relative luate din tabelul periodic al lui DI Mendeleev sunt rotunjite la întregi).
Domnul (C2H4) = 2 × 12 + 4 × 1 = 24 + 4 = 28.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor să se arate că valorile numerice ale masei moleculare M și ale masei moleculare relative sunt egale, dar prima cantitate are dimensiunea [M] = r / mol, iar a doua dimensiune este fără dimensiuni:
Aceasta înseamnă că masa molară a etilenei este de 28 g / mol.
Exemple de rezolvare a problemelor
Prepararea compusului cu formula mangan cu oxigen atunci când fracțiile masice ale elementelor în ea: ω (Mn) = 63,2%, ω (O) = 36,8%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să denotăm numărul de moli ai elementelor care compun compusul pentru "x" (mangan) și "y" (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al DI Mendeleev sunt rotunjite la întregi):
x: y = ω (Mn) / Ar (Mn). ω (O) / Ar (O);
x: y = 63,2 / 55. 36,8 / 16;
x: y = 1,15. 2.3 = 1. 2.
Prin urmare, formula compusului de mangan cu oxigen va avea forma MnO2. Acesta este oxidul de mangan (II).
Prepararea compusului cu formula de hidrogen, iod și oxigen, în cazul în care fracțiile masice ale elementelor în ea: w (H) = 2,2%, ω (I) = 55,7%, ω (O) = 42,1%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să denotăm numărul de elemente moleculare care compun compusul pentru x (hidrogen), y (iod), z (oxigen). Apoi, raportul molar va fi după cum urmează (valorile maselor atomice relative luate din Mendeleev Tabelul periodic, rotunjită la numere întregi):
x: y: z = ω (H) / Ar (H). (I) / Ar (I). ω (O) / Ar (O);
x: y: z = 2,2 / 1. 55,7 / 127: 42,1 / 16;
x: y: z = 2,2. 0,44: 2,63 = 5,1.
Prin urmare, formula pentru combinarea hidrogenului, iodului și oxigenului va avea forma H5106.
Articole similare
Trimiteți-le prietenilor: