STRUCTURA ATOMULUI FOSFORUS
Fosforul este situat în perioada a III-a, în grupa 5 a subgrupului principal "A", sub numărul 15. Masa atomică relativă Ar (P) = 31.
1 S 2 2 S 2 2 P 6 3 S 2 3 P 3. fosfor: p - element, nemetal
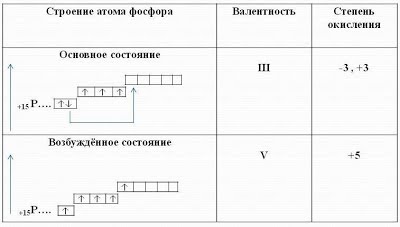
Posibilitățile valente ale fosforului sunt mai largi decât cele ale atomului de azot, deoarece există d-orbitale libere în atomul de fosfor. Prin urmare, se poate face împerecherea a 3 electroni S2 și una dintre ele poate trece la 3 d - orbital. În acest caz, la cel de-al treilea nivel de energie al fosforului există cinci electroni nepermani, iar fosforul poate prezenta valența lui V.
Într-o stare liberă, fosforul formează mai multe modificări alotropice: fosfor alb, roșu și negru
Fiind în natură
ROLUL BIOLOGIC AL CONEXIUNILOR FOSFORUS
Fosforul este prezent în celulele vii ca acizii orto- și pirofosforic, o parte din nucleotide, acizi nucleici, fosfoproteidov, fosfolipide, coenzime, enzime. Oasele osoase constau din hidroxilapatita 3Ca3 (PO4) 3 · CaF2. Compoziția smalțului dinților include fluorapatită. Rolul principal în transformarea compușilor fosforului în organism de piese de ficat uman și animal. Compuși de schimb de fosfor reglementate de hormoni și vitamina D. Necesarul uman zilnic pentru fosfor 800-1500 mg. Cu o lipsă de fosfor în organism, se dezvoltă diverse boli osoase.
· Fosforul roșu este practic netoxic. Praful de fosfor roșu, care intră în plămâni, cauzează pneumonia în cazul acțiunii cronice.
· Fosforul alb este foarte toxic, solubil în lipide. Doza letală de fosfor alb este de 50-150 mg. Folosind pe piele, fosforul alb dă arsuri grave.
Intoxicație acută manifestată de fosfor de arsură în gură și stomac, dureri de cap, slăbiciune, vărsături. După 2-3 zile se produce icter. Pentru formele cronice caracterizate de tulburări ale metabolismului calciului, înfrîngerea sistemului cardiovascular și nervos. Primul ajutor în intoxicații acute - lavaj gastric, laxative, clisme de curățare, soluții intravenoase de glucoză. Atunci când pielea arde, tratați zonele afectate cu soluții de sulfat de cupru sau sifon. MPC a vaporilor de fosfor în aer este de 0,03 mg / m³.
Fosforul este obținut din apatite sau fosforite ca urmare a interacțiunii cu cocsul și silicele la o temperatură de 1600 ° C:
Pereții de fosfor alb care rezultă se condensează în recipient sub apă. În loc de fosforit, alți compuși pot fi supuși reducerii, de exemplu acid metafosforic:
PROPRIETATI CHIMICE ALE FOSFORULUI
Fosforul este un element biogen important și, în același timp, găsește o aplicație foarte largă în industrie.
Poate că prima proprietate a fosforului, pe care o pune omul în slujba sa, este inflamabilitatea. Combustibilitatea fosforului este foarte mare și depinde de modificarea alotropică.
Cel mai activ chimic, toxic și combustibil alb ("galben"), fosfor. deoarece este adesea folosit (în bombe incendiare etc.).
Fosforul roșu este principala modificare produsă și consumată de industrie. Acesta este utilizat în producția de chibrituri ea cu sticlă măcinat fin și este aplicat adeziv pe suprafața laterală a cutiei, frecarea în compoziția cap meci care cuprinde clorat de potasiu și sulf, are loc aprinderea. De asemenea, fosforul roșu este utilizat în producția de explozivi, compuși incendiare, combustibili.
Fosforul (ca fosfat) - unul dintre cele trei elemente nutritive majore, este implicată în sinteza ATP. Cele mai multe acid fosforic produs se duce la îngrășăminte cu fosfor - precipitat superfosfat, et al.
Oxid de fosfor (V) - anhidridă fosforică
Proprietăți fizice: Oxidul de fosfor (V) P2O5 - pulberea higroscopică albă (absorbția apei) trebuie depozitat în recipiente închise etanș.
Preparare: Se obține prin arderea de fosfor în exces de aer sau de oxigen
Aplicare: Oxidul de fosfor (V) combină foarte viguros cu apă și, de asemenea, îndepărtează apa de la alți compuși. Se utilizează ca un dezumidificator pentru gaze și lichide.
Proprietati chimice: Oxidul de fosfor (V) este un oxid acid. interacționează, ca și alte oxizi de acizi cu apă, oxizi de bază și baze.
Anhidrida fosforică reacționează cu apă într-un mod special, interacționând cu apa în condiții obișnuite (fără încălzire). formează în primul rând acidul metafosforic NPO3:
când este încălzit, acidul ortofosforic H3P04:
Valoarea cea mai practică este acidul ortofosforic H3PO4.
Structura moleculei: Într-o moleculă de acid fosforic, atomii de hidrogen sunt conectați cu atomi de oxigen:
Proprietăți fizice: Acidul fosforic este un solid incolor, higroscopic, ușor de solubil în apă.
1) Interacțiunea dintre oxidul de fosfor (V) și apa după încălzire:
2) Interacțiunea sarei naturale - ortofosfat de calciu cu acid sulfuric cu încălzire:
3) În interacțiunea fosforului cu acidul azotic concentrat
Trimiteți-le prietenilor: