ortofosfații, pirofosfații (difosfații) și condensatul. fosfații de sodiu. Cristalin. sau substanțe sticloase, bine solubile. în apă pentru a forma hidrati cristaline (vezi. Tabelul. 1.2). Ortofosfatul Na3P04. d și g fotofracției de NaH2P04 și g de fotofactor Na2HP04 sunt produse reciproc. H3P04 cu Na2C03 sau NaOH cu acesta din urmă. cristalizarea sărurilor și uscarea acestora în săruri anhidre sau hidrați cristalini NaH2P04. H2O, Na2HP04. 12H20 și Na3P04. 12H2O. Acesta din urmă este de asemenea obținut prin încălzirea AlPO4 cu Na2C03 la 900 ° C cu acesta din urmă. scurgerea cu apă și cristalizarea din p-ra.
Pirofosfatul Na4 P2O7 este polimorfic; trihidro-NaH3P2O7. dihidro-Na2H2P2O7 și hidrofirofosfații Na3HP2O7 se descompun la peste 250 ° C pentru a forma compuși de hidrogen condensați. Se obține prin neutralizarea H4P2O7 cu alcaline, deshidratarea hidroortofosfatului Na, Na3HP2O7 x 9H2O prin acidularea soluției Na 4 P 2 O 7 cu un acid clorhidric.
Tabelul 1. - PROPRIETĂȚI DE ORTO- ȘI PIROFOSFATURI DE SODIU
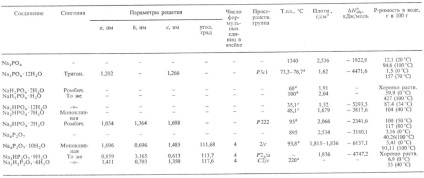
a Cu pierderea apei, deshidratare completă la 100 ° C> Deshidratare completă la 95 ° C în deshidratare completă C> pierderea a 5 molecule de apă. q Pierde o moleculă de apă, care nu se topește.
Tabel. 2. CARACTERISTICILE FOSFATELOR CONȚINUTE DE SODIU
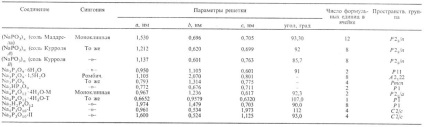
Conventional N. f. (metafosfați de sodiu învechiți) conțin o grupare (PO 3) -. Polifosfații au o structură liniară de lanț, ciclofosfat (NaPO3) n. unde n = 3,4,12-ciclic.
Tetracicofosfatul Na4P4O12 poate avea un scaun sau o baie conformatională. Sarea anhidră este cunoscută numai în conformația băii. Tetraciclofosfatul Na este obținut prin metoda de preparare. valorile echimolare ale NaH2P04 și H3P04 la 400 ° C cu cele din urmă. răcirea lentă a topiturii. Na2 H2P4O12 rezultat este neutralizat prin formula NaOH. Et al. metoda constă în neutralizarea soluției de H4P4O12 cu alcaline la pH 7 cu răcire.
Trifosfat trifosfat trifosfat Na5P3O10. având o structură liniară a lanțului, există în două modificări, tranziția m II 417 ° C. Formată prin topirea unui amestec de sare Graham cu Na4 P2O7 cu acesta din urmă. răcirea lentă, deshidratarea unui amestec de Na2HP04 și NaH2P04 la 350-400 ° C (Forma II) sau la 500-550 ° C (I). Numărul de trifosfați este de 70% din totalul fabricat în industrie, fosfați alcalini.
N. f. sunt utilizate ca componente ale detergenților, cum ar fi agenți de înmuiere a apei, detergenți pentru curățarea metalelor, agenți tensioactivi pentru producerea cimenturilor și pentru găurirea puțurilor de țiței. Un efect detergent deosebit de bun este sintetic. Agenți de spălare cu adaos de trifosfat de sodiu (10-50%). Pentru a elimina duritatea apei, se folosește NF deshidratat. formând complexe cu Mg, Ca, Ba și alte metale. N. f. sunt utilizate în îmbogățirea minereurilor, în producția de pahare de fosfat, vopsele, etc. ca aditivi sau materii prime, ca auxiliare textile. in-va, în alimente. prom-sti (aluat dezintegrat, pentru omogenizarea și îmbunătățirea consistenței brânzeturilor, cârnaților, laptelui condensat), în fotografie (componentele dezvoltatorului), în electrolitică. procese etc.
REFERINȚE Corbridge D. Phosphorus. Bazele chimiei, biochimiei, tehnologiei, trans. cu engleza. M. 1982; Chimie anorganică comprehensivă, ed. de J.C. Bailar, A. F. Trot-man-Dickenson, v. 1, Oxf. 1973. L. N. Komissarova, P. P. Melnikov.
Enciclopedii chimice. - Enciclopedia Sovietică. Ed. I. L. Knunyants. 1988.
Articole similare
Trimiteți-le prietenilor: