Echipamente și materiale
Flacoane pentru 250 și 500 ml; o sticlă de 300 ml; sticlă și tuburi din cauciuc; clip; dopuri de cauciuc cu găuri; hârtie de filtru; hârtie de urmărire; cântare; cilindru gradat pentru 100 ml; agregate de magneziu; acidul sulfuric este diluat.
Ordinea lucrării.
Lucrarea este realizată de doi studenți!
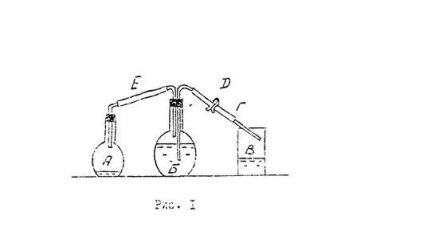
Pentru a determina masa molară a echivalentului de magneziu, dispozitivul prezentat în Fig. 1.
Dispozitivul constă din un balon de 250 ml balon volum 500 ml B- B 300 ml volum pahar. Un balon echipat cu un dop de cauciuc, introdus în acesta, cu un tub de sticlă scurt, care este furtun de cauciuc uzat E. La balon B este proiectat cu dop doi cauciuc introdus în el prin tuburi de sticlă, dintre care unul este de cauciuc uzate furtun E, iar furtunul de cauciuc cu druguyu- sifonul G și clema D.
a) Se măsoară cilindrul și se toarnă 25 ml de acid sulfuric diluat în balonul A, încercând să se evite umezirea gâtului balonului. Dacă picăturile de acid cad pe ea, îndepărtați-le cu atenție cu hârtie de filtru.
b) Pe o bucată de hârtie de urmărire, cântărește aproximativ 0,1 g de așchii de magneziu pe cântare cu o precizie de 0,001 g.
c) Se toarnă apă de la robinetul B până la partea superioară a gâtului balonului.
d) Se sigilează bine balonul B cu dop cu două tuburi.
d) Se umple capcana de apă T, care înclinați balon B deasupra chiuvetei spre tubul sifonului și deschide clema D. Se lasă apa să se deplaseze tot aerul din sifonul și închideți clema.
Asigurați-vă că apa nu se scurge din sifon și nu conține bule de aer. Dacă aceste condiții nu se aplică, contactați tehnicianul de laborator pentru ajutor.
e) Clătiți cilindrul cu apă de la robinet și măsurați 50 ml de apă (la marginea de jos a meniscului), turnați apa în paharul B și împingeți sifonul în el.
g) Înclinați balonul A în poziție orizontală, evitând introducerea acidului sulfuric în gâtul balonului și plasați cu atenție trasorul cu șurete de magneziu, împiedicând pătrunderea magneziului în acid.
h) Una dintre lucrările de fixează balon B, prevenind căderea acestuia și se pregătește să deschidă clema D. În al doilea rând, ținând vasul și în poziție orizontală, etanșeizează dopul cu tubul de evacuare E și pune pe masă, fixarea celor două brațe ale balonului, pentru a le evita toamna. Primul student deschide simultan clema. Asigurați-vă că sifonul este întotdeauna scufundat în lichid!
i) Dacă nu toate magnezii au intrat în acid, este necesar, ținând balonul B, cu atenție pentru a muta bulbul A, după ce a intrat în acid tot magneziul.
j) Așteptați dizolvarea completă a magneziului în acid (oprirea eliberării bulelor de hidrogen).
k) Fixarea sifonului imersat în lichid uniformiza suprafața apei în balon B și sticlă B, pridvinuv-le împreună și cu grijă ridicarea sau vas de sticlă, în funcție de unde nivelul apei este mai mare. După ce ați atins coincidența nivelurilor de lichid, dați comanda pentru a închide clema. Evitați răsturnarea flaconului A!
m) Volumul de apă deplasat din balonul B în paharul B este egal cu volumul de hidrogen eliberat în balonul A în timpul reacției dintre magneziu și acid sulfuric. Pentru a determina volumul de apă deplasată, trebuie să scoateți sifonul din sticlă și să turnați apa în cilindrul gradat. Dacă volumul apei este mai mare de 100 ml, trebuie să măsurați cilindrul de 100 ml de apă din sticlă, să-l vărsați în chiuvetă și apoi turnați resturile de apă în cilindru, determinând volumul total. Din valoarea obținută, trebuie să scăpați 50 ml, care au fost turnate în prealabil în geam. Înregistrați valoarea volumului Vmăsură primită. Dacă rezultatul experimentului nu este acceptat de profesor, experiența trebuie repetată.
Procesarea rezultatelor experimentale. (Partea estimativă).
Valoarea obținută a volumului de hidrogen poate fi utilizată pentru a calcula masa echivalentului de magneziu numai după reducerea sa la condițiile normale. Trebuie avut în vedere că presiunea gazelor deasupra apei din balonul B, echilibrată prin presiunea atmosferică, este determinată de hidrogenul și vaporii de apă eliberați: P = Pvodor. + h
P este presiunea atmosferică, h este presiunea vaporilor de apă saturați la temperatura experimentului.
V0 este volumul de hidrogen eliberat în condiții normale, ml.
P - presiunea atmosferică, mm. Hg. Art. determinată de barometru.
h - presiunea vaporilor de apă saturați, mm. Hg. Art. la temperatura experimentului,
determinată conform tabelului. 1
t este temperatura experimentului, o C, determinată de la termometru în laborator.
Tabelul 1 Presiune de vapori de apă saturată la diferite temperaturi
Articole similare
Trimiteți-le prietenilor: