Teoria cinetică moleculară face posibilă înțelegerea motivului pentru care materia poate fi în stare gazoasă, lichidă și solidă.
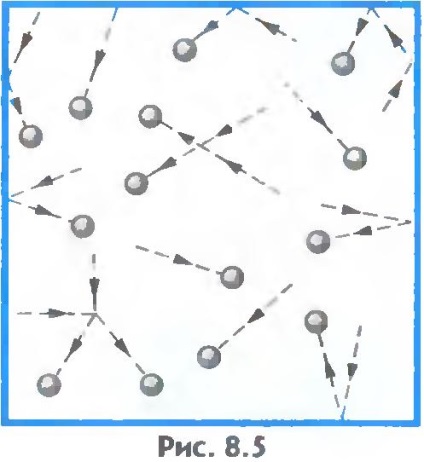
Gaza. În gaze, distanța dintre atomi sau molecule este, în medie, de multe ori mai mare decât dimensiunile moleculelor în sine (figura 8.5). De exemplu, la presiunea atmosferică, volumul vasului este de zeci de mii de ori mai mare decât volumul de molecule din el.
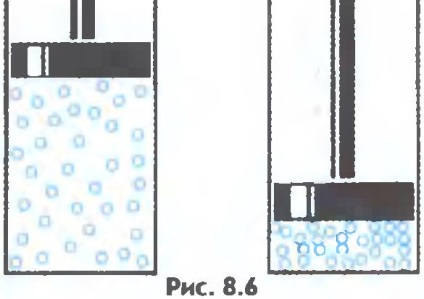
Gazele sunt ușor comprimate, în timp ce distanța medie dintre molecule scade, dar forma moleculei nu se modifică (figura 8.6).
Moleculele cu viteze uriașe - sute de metri pe secundă - se mișcă în spațiu. Cu fața în față, ei izbucnesc unul de altul în direcții diferite, cum ar fi bilele de biliard. Forțele slabe de atracție a moleculelor de gaze nu le pot menține unul lângă celălalt. Prin urmare, gazele se pot extinde nelimitat. Ele nu păstrează nici o formă sau un volum.
Numeroasele impacturi ale moleculelor asupra peretelui vasului creează o presiune a gazului.
Lichid. moleculele lichide sunt aranjate foarte aproape unul de altul (ris.8.7) molecula deci lichid se comportă diferit față de o moleculă de gaz. În lichide, există așa-numitele ordine rază scurtă de acțiune, adică. Dispunerea moleculelor conservate la distanțe egale cu câteva diametre moleculare E. ordonata. Molecula oscilează aproape de poziția sa de echilibru. ciocnirea cu moleculele vecine. Doar din când în când ea face un alt "salt", care se încadrează într-o nouă poziție de echilibru. În această poziție de echilibru, forța repulsivă este egală cu forța atractivă, adică forța interactivă totală a moleculei este zero. timp de viață sedentar a moleculelor de apă, t. E. In timpul oscilației sale cu privire la o anumită poziție de echilibru, la temperatura camerei, egală în medie 10 -11 s. Timpul unei vibrații este mult mai mic (10 -12 -10 -13 s). Pe măsură ce crește temperatura, durata de viață a moleculelor scade.

Natura mișcării moleculare în lichide, stabilită inițial de fizicianul sovietic Ya.I.Frenkel, face posibilă înțelegerea proprietăților de bază ale lichidelor.
Moleculele lichidului sunt direct unul lângă celălalt. Pe măsură ce volumul scade, forțele repulsive devin foarte mari. Aceasta explică compresibilitatea scăzută a lichidelor.
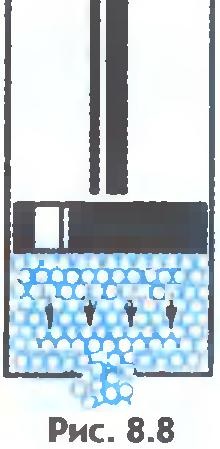
După cum este cunoscut, fluxurile de fluide, adică, nu își păstrează forma. Puteți explica acest lucru în acest fel. Forța externă nu modifică semnificativ numărul de sărituri moleculare pe secundă. Dar sarele moleculelor dintr-o poziție stabilită în alta au loc în primul rând în direcția acțiunii forței exterioare (Fig.8.8). De aceea, lichidul curge și ia forma unui vas.
Corpuri solide. Atomii sau moleculele de solide, spre deosebire de atomi și molecule de lichide, fluctuează în apropierea anumitor poziții de echilibru. Din acest motiv, solidele rețin nu numai volumul, ci și forma. Energia potențială a interacțiunii moleculelor unui solid este mult mai mare decât energia lor cinetică.
Există o altă diferență importantă între lichide și solide. Lichidul poate fi comparat cu o mulțime de oameni, în cazul în care unele persoane se înghesuie stînjenit în loc și solide, cum ar fi un grup subțire de aceleași persoane care, deși nu în picioare la o atenție, dar este menținută între o anumită distanță, în medie. Dacă vă conectați centrele de poziții de echilibru ale atomilor sau ionilor ai corpului solid, veți obține zăbrele spațială corectă, numit cristalul.
Figurile 8.9 și 8.10 prezintă laturile cristaline ale sarei de masă și diamantului. Ordinea internă în aranjamentul atomilor de cristal conduce la corectarea unor forme geometrice exterioare.
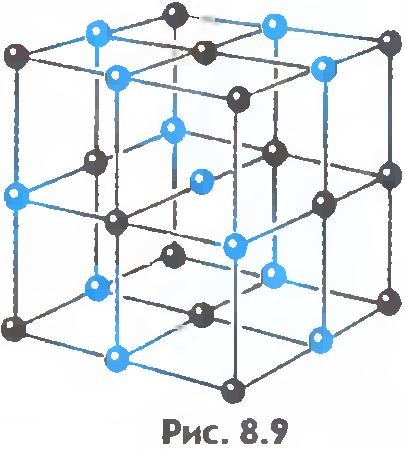
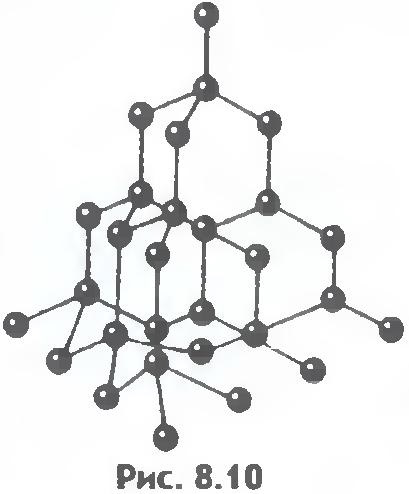
Figura 8.11 prezintă diamantele Yakut.
Pentru un gaz, distanța l între molecule este mult mai mare decât dimensiunile moleculare: r0> l> r0.
Pentru lichide și solide, este vorba despre r0. Moleculele lichidului sunt dezorientate și din când în când sare dintr-o poziție stabilită în alta.
În solidele cristaline, moleculele (sau atomii) sunt strict ordonate.
.
1. Gazul este capabil de expansiune nelimitată. De ce există atmosfera pe Pământ?
2. Care este diferența dintre traiectoriile de mișcare ale gazelor, lichidelor și moleculelor solide? Desenează traiectoriile aproximative ale moleculelor de substanțe în aceste stări.
G.Ya.Myakishev, B.Buhovtsev, N.N.Sotsky, Fizica clasei a 10-a
Colecție de note de lecții pentru toate clasele, temele, descărcați eseuri despre fizică. cărți și manuale în funcție de planificarea fizicii pentru clasa a 10-a
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.
Articole similare
Trimiteți-le prietenilor: