KINETICA PROCESELOR ELECTRODE
În condiții de electroliză, atunci când curentul trece prin electrod, potențialul electrodului variază în comparație cu valoarea sa de echilibru. Această schimbare a potențialului electrodului se numește polarizarea electrodului sau supratensiunea reacției electrodului. Polarizarea este cauzată de cursul procesului electrochimic și, prin urmare, există întotdeauna o legătură între viteza procesului și, prin urmare, densitatea curentului la electrod și polarizarea. Sarcina cineticii electrochimice este de a stabili natura acestei conexiuni pentru a controla conștient cursul procesului electrochimic.
Procesul electrochimic constă în mai multe etape succesive: transportul materiei pe suprafața electrodului, reducerea electrochimică sau reacția de oxidare la electrod și îndepărtarea produselor de reacție. În unele cazuri, un rol important jucat de reacții chimice: omogeni, care curge în electrolit în apropierea suprafeței electrodului și eterogenă - pe suprafața electrodului. În primul caz, substanța care este transportată la electrod intră în reacția electrochimică, dar produsele degradării sau interacțiunii cu alte substanțe conținute în electrolit. O astfel de reacție precede etapa electrochimică. În cel de-al doilea caz, ca rezultat al descărcării electrochimice, nu se obține substanța finală, ci o parte intermediară, adsorbită de electrod. Apoi, are loc o reacție eterogenă a tranziției acestei substanțe la produsul final. Uneori este necesar să se ia în considerare ritmurile de formare a unei noi faze, care apare ca urmare a unei reacții electrochimice - cristalele unui solid. picături de bule metalice și gaze.
În funcție de care dintre aceste etape este limitarea, adică cea mai lentă, se disting următoarele tipuri de polarizare sau supratensiune (conform Vetter).
Supratensiunea tranziției se datorează încetinirii ionizării etapelor de descărcare. Relația dintre supratensiune și densitatea curentului este descrisă de ecuația Tafel:
unde C este densitatea curentului, A / cm2; a și b sunt constante. Pentru procesul de anod
unde k1 este constanta vitezei procesului electrochimic, 1 / s; α - coeficient de transfer (coeficient cinetic), fracțiune. u
În procesul electrochimic, energia potențială a ionului în electrolit și produsul final de pe electrod este diferită. Energia de activare a reacției electrodului nu include întreaga diferență a acestor energii, ci doar o parte din ea. Coeficientul de transfer d este raportul dintre această parte a energiei și energia totală.
Pentru procesul catodic, în care concentrația (activitatea) ionilor determinanți potențiali joacă un rol, constantele ecuației Tafel vor avea următoarele valori:
unde C este concentrația de ioni, mol / cm3; β - coeficient de transfer pentru procesul catodic, fracțiune de unități.
Suma coeficienților de transfer a și B este una și se presupune că a = β = 0,5.
Orice procedeu electrochimic (și chimic) are loc atât în direcția directă, cât și în cea inversă. Continuând procesul din echilibru, cu atât mai mult procesul direct predomină peste invers și viceversa. La echilibru, ratele proceselor forward și invers sunt egale. Curentul de schimb și reprezintă viteza procesului electrochimic în direcțiile directe și inverse la un potențial de echilibru. După cum rezultă din relație. cu o creștere a curentului de schimb, supratensiunea joncțiunii scade. Dacă i0 »i. apoi supratensiunea este aproape de zero, iar procesul poate fi considerat un echilibru (reversibil).
De obicei curenții de schimb în sărurile topite sunt mari - de la unități la sute de amperi pe centimetru pătrat, ceea ce este asociat cu accelerarea proceselor la temperaturi ridicate.
Difuzarea supratensiunii
Aceasta se datorează întârzierii transferului substanțelor care reacționează. Acest transfer poate fi realizat prin difuzie moleculară, migrare (transfer sub acțiunea câmpului electric de particule încărcate - cationi și anioni) și convecție (transport fluid). De obicei, convecția este cauzată de gazele eliberate la anod. Efectul transferului de migrație poate fi redus semnificativ prin crearea unui fundal în care transferul de energie electrică este realizat de către alți ioni care nu se descarcă. Transferul are loc în electrolizași de aluminiu.
Procesul principal de limitare este, de obicei, difuzia moleculară, cel mai lent proces. Dacă difuzia are loc la un electrod plat, atunci curentul de difuzie (pentru procesul de catod) poate fi calculat din expresia primei legi a lui Fick:
unde Co este concentrația de ioni în adâncimea electrolitului; C8 este concentrația de ioni pe suprafața electrodului, -δ este grosimea stratului de difuzie; D este coeficientul de difuzie.
Grosimea stratului de difuzie depinde de condițiile de amestecare a electrolitului - cu cât este mai mare viteza fluxurilor care curg în jurul electrodului, cu atât este mai mică valoarea de 6. În electroliza sărurilor topite, grosimea stratului de difuzie este de obicei de 0,1 până la 1 mm.
Pentru electrozii lichizi în săruri topite a fost observat (. Polyakov et al), Grosimea stratului de difuzie scade datorită efectului Marangoni: tensiunea interfacială la metal - electrolit are un sens diferit în diferite părți ale suprafeței electrodului, provocând curgerea lichidului din zonele cu interfaciale inferioară tensiune în zone cu o tensiune interfacială mare. Această amestecare suplimentară poate reduce δ cu un ordin de mărime.
Atunci când concentrația C scade, curentul maxim de difuzie este obținut la zero, așa-numitul curent de difuzie limitator: id = nFDC0 / δ.
Relația dintre curentul de supratensiune și difuzie este dată de expresia:
din care rezultă că în regiunea curentului limitator există o deplasare bruscă a potențialului către partea negativă și o suprafață limită de curent este marcată pe curba de polarizare. Potențialul electrodului este astfel mutat astfel încât să înceapă descărcarea unui alt cation mai electronegativ (de exemplu, cationul de fond). Dacă curba de polarizare a construi pana la limita de curent, linia dreaptă obținută panta care permite determinarea coordonatelor în -1n revendicarea ηd (1-i / id) - numărul de electroni implicați în reacțiile electrochimice.
Dacă supratensiunea este determinată de încetinirea difuziei de anioni în timpul descărcării anodice, ecuația corespunzătoare pentru cuplajul dintre curentul de difuzie și supratensiune va fi
unde id este curentul de difuzie limitativ al anionilor, A / cm2.
Excesul de reacție
Aceasta este cauzată de încetinirea reacțiilor chimice la etapele anterioare sau ulterioare descărcării-ionizare. Să considerăm reacția eterogenă după descărcarea de gestiune, cea mai importantă pentru prezentarea ulterioară.
Să presupunem că procesul electrochimic constă în două etape consecutive: substanțe oxidante R: R- ne ⇄ ° C pentru a forma o substanță O intermediar oxidată, adsorbit pe suprafața electrodului, heterogen de reacție O ⇄ A. la care un produs final A. Să presupunem că etapa de descărcare curge rapid, practic în echilibru, în timp ce reacția eterogenă ulterioară este lentă. Viteza acestei etape lentă constă în viteză directă proces proporțională cu concentrația de suprafață a substanței în p O grad (ordinea de reacție), iar viteza procesului invers υ = υ - υ = kC0 p - υ, unde k - constanta vitezei de reacție în cm / sec.
Atunci când aceste procese sunt viteza de echilibru: υ0 = υ = υ = kC0 p în care C0 - concentrația de suprafață a unei substanțe în echilibru mol / cm 2. Dacă în procesul unui exces mare de compus A și concentrația sa este independentă de potențial, și este independentă C0 Supratensiunea reacției este dată de:
unde Co este concentrația de suprafață a substanței O sub polarizare. Viteza procesului sau densitatea curentului
Ho nF υ0 = i0 este densitatea curentului la echilibru (curent de schimb), prin urmare
Expresiile (34) și (35) implică o legătură între densitatea curentului și supratensiune:
Dacă i / io »1, obținem ecuația Tafel:
Coordonatele ηr - ln i această relație este o linie dreaptă, ca și în cazul tensiunii de transfer, dar în loc să transfere coeficient apare eterogen reacție chimică ordine p și coeficientul b în ecuația Tafel va fi semnificativ mai mică.
2. Mecanismul procesului catodic
Procesul catodic include următoarele etape secvențiale: transportul de complexe fluorură și fluorură conținând ioni de aluminiu de la adâncimea topiturii la catod; degradarea complecșilor într-un strat dublu cu formarea ionilor liberi Al 3+. și descărcarea ionilor Al3 +. Nu este exclus ca descărcarea să apară direct de la ionii complexi, ocolind stadiul degradării lor. Când recuperarea aluminiului din criolit-alumină se topește la catod indiferent (de exemplu, tungsten) Curbele de polarizare detectată la două situsuri (Antipin) corespunzătoare a două procese: Al 3+ + 2e = Al, Al + e = Al. Dacă catodul este aluminiu lichid. nu există nici un proces de reîncărcare, deoarece în prezența aluminiului se stabilește rapid echilibrul dintre ionii Al 3+. Al + și metal.
Măsurători de impedanță, adică investigarea rezistenței complexe a sistemului de electrozi topit aluminiu-criolit-alumină într-un circuit de curent alternativ
în funcție de frecvență, ne-a permis să estimăm valoarea curentului de schimb pentru acest sistem. Sa dovedit că schimbul electroliza curent, la o temperatură de aproximativ 20 de electrod A / / cm 2. m. E. Aluminiul este substanțial tranziție reversibilă și tulpina este de numai câteva milivolți. Aceste măsurători au indicat natura difuziei supratensiunii.
Studii de aluminiu electrod de polarizare în celula de laborator (Sts, etc.), în condițiile în care procesul anodic a fost limitat la dizolvare aluminiu (t. E. Gazul anod nu este alocată) și agitarea anolit și catolit a fost minimă a arătat că curbele de polarizare sunt limita pad (Figura 17, curba I).
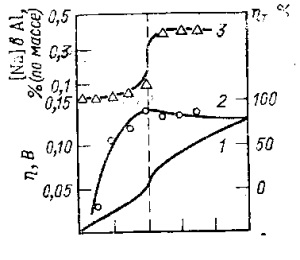
Datorită creșterii densității de curent în stratul catodic apropiat, concentrația de oxifluorură complexă și ionii de fluorură care conțin cationi de Al 3+ scade. iar concentrația de ioni de Na + crește. Deoarece electrod reversibil (tranziție la supratensiune este absent), concentrația de Na + creșterea ionilor conduce la o creștere a conținutului de sodiu din aluminiu și potențiala schimbare în direcția negativă. Prin urmare, există o descărcare comună a ionilor de alumină și sodiu, nu numai de sodiu este eliberat într-o fază separată (flacon la presiune atmosferică) și dizolvat în aluminiu în sare topită.
Astfel, în toate condițiile de electroliză există o descărcare comună a aluminiului și a sodiului, acesta din urmă eliberându-se de obicei ca soluție în aluminiu. Deoarece ambele metale sunt eliberate pe un singur electrod, potențialul lor ar trebui să fie același:
Când este polarizat, catolitul este îmbogățit cu fluorură de sodiu și epuizat de fluorură de aluminiu în comparație cu compoziția de echilibru. Prin urmare, polarizarea catodului este ee. etc cu. lanț de concentrație:
Aici, compoziția electrolitului și a aliajului de aluminiu-sodiu pentru electrodul de echilibru sunt prezentate în prima jumătate de element, în a doua jumătate a polarizării,
Ed cu. lanțul este
Potențialul de difuzie la interfața semiprelucrărilor:
deoarece curentul este transferat numai de ionii de sodiu. prin urmare
Folosind expresia pentru constanta de echilibru a reacției
Electroliții și metalul din băile industriale sunt în mișcare continuă, în timp ce pe suprafața metalică se formează valuri. Mișcarea electrolitului și a metalului contribuie la îndepărtarea supratensiunii de difuzie, iar electrodul de aluminiu este practic în echilibru.
Izolarea de sodiu pe aluminiu este determinată în principal de raportul temperatură și baie: cu cât este, iese de sodiu mai multe. Sodiu frunze de aluminiu în două moduri: 1) se dizolvă în electrolit, transferat la anod și oxidat; 2) trece prin grosimea de aluminiu și este absorbită de căptușeala cărbunelui. Prima cale duce o pierdere semnificativă de putere și la o scădere a eficienței curente, al doilea - pentru a prematură celulele mucoasei eșec de carbon.
Știi cum
Trimiteți-le prietenilor: