hidroliza adenilaților aminoacilici anormali. Datorită existenței în situsul activ al acestor enzime mecanism de corecție pentru a asigura îndepărtarea imediată a resturilor de aminoacizi în mod greșit adjoint se realizează o precizie extrem de ridicat: pentru 1300 legate de ARNt aminoacizii au găsit doar o singură eroare.
Aminoacid determină aderarea ARNt nu mai departe proprietățile specifice ale aa-ARNt, deoarece structura ei nu recunoaște nici ribozom sau ARNm. Participa la sinteza proteinelor depinde numai de structura ARNt, sau mai degrabă a anticodon interacțiune complementară aminoacil-ARNt cu ARNm codon.
Anticodonul este localizat în bucla centrală (anticodon) din tARN. Recunoașterea tARN prin sinteteaza aa-tRNA nu se produce întotdeauna prin buclele anticodonale. Centrul activ al anumitor enzime prezintă o corespondență complementară cu alte părți ale structurii spațiale a tARN.
Ribosomii sunt formațiuni ribonucleoproteinice - "fabrici" distinctive pe care aminoacizii sunt asamblați în proteine. Ribozomii eucariotali au o constantă de sedimentare de 80S și constau din subunități 40S (mici) și 60S (mari). Fiecare subunitate include rRNA și proteine. Subunitatea 40S conține rRNA cu o constantă de sedimentare de 18S și aproximativ 30-40 de proteine. În subunitatea 60S, s-au detectat 3 tipuri de ARN: 5S, 5.8S și 28S și aproximativ 50 de proteine diferite.
Proteinele fac parte din subunitățile de ribozomi în cantitate de o copie și efectuează o funcție structurală, asigurând interacțiunea dintre ARNm și tARN asociat cu aminoacidul sau peptida.
În prezența ARNm 40S și 60S, subunitățile sunt combinate pentru a forma un ribozom complet, a cărui masă este de aproximativ 650 ori mai mare decât masa moleculei de hemoglobină.
În ribozom există două centre pentru atașarea moleculelor tARN: centri aminoacil (A) și peptidil (P), în formarea cărora participă ambele subunități. Împreună, centrele A și P includ o regiune mRNA egală cu 2 codoni. În timpul traducerii, Centrul A asociază aa-tARN, a cărui structură este determinată de codonul situat în regiunea acestui centru. În structura acestui codon, natura aminoacidului este codificată, care va fi inclusă în lanțul de polipeptide în creștere. Centrul P ocupă peptidil-tARN, adică tRNA asociat cu un lanț peptidic care a fost deja sintetizat.
În eucariote, ribozomii se disting prin tipul 2 "liber", găsit în citoplasma celulelor și asociat cu reticulul endoplasmatic (ER). Ribosomii asociați cu ER sunt responsabili pentru sinteza proteinelor "pentru export", care intră în plasma sanguină și participă la reînnoirea proteinelor ER; membrana aparatului Golgi, mitocondriile sau lizozomii.
Mitochondria conține un set propriu de ribozomi. Ribozomii mitocondriali sunt mai mici decât ribozomii de eucariote, procariote și au o constantă de sedimentare de 55S. Ele constau, de asemenea, din două subunități, dar diferă de ribozomii eucariote prin cantitatea și compoziția ARN și a proteinelor.
Factori de proteine
În fiecare etapă a sintezei proteinelor pe ribozom: inițierea, alungirea și terminarea a implicat un set diferit de factori de proteină non-ribozomali. Aceste proteine se leagă de ribozom sau de subunitățile sale în anumite etape ale procesului și stabilizează sau facilitează funcționarea mașinii de sinteză a proteinelor.
ATP și GTP ca surse de energie
La încorporarea unui aminoacid într-o cușcă cu lanț polipeptidic în creștere expends bond energie 4 2 ATP în reacția catalizată de sintetaza aa-ARNt (ATP în timpul activării aminoacizilor este clivat la AMP și pirofosfat) și molecula de 2 GTP: unul folosit pentru aa legare tRNA în centrul A al ribozomului, iar al doilea se cheltuiește în stadiul de translocare. Prin aceasta | trebuie adăugată utilizarea altor două legături de mare energie de molecule: ATP și GTP privind inițierea și terminarea sintezei lanțului polipeptidic.
Etapele de sinteză a lanțului polipeptidic
Sinteza proteinelor este un proces volatil ciclic, în mai multe etape, în care aminoacizii liberi polimerizează într-o secvență determinată genetic pentru a forma polipeptide. sistem proteic de sinteză, sau mai precis un sistem de emisie care utilizează informațiile genetice transcrisă în ARNm pentru sinteza unui lanț polipeptidic, cu o anumită structură primară, include aproximativ 200 de tipuri de macromolecule - proteine și acizi nucleici. Dintre acestea, aproximativ 100 dintre macromoleculele implicate în activarea aminoacizilor și a le transfera la ribozomi, mai mult de 60 macromoleculelor care alcătuiesc 70S sau 80S ribozomii, 10S și aproximativ macromoleculele, direct implicate în sistemul de traducere. Fără a discuta natura sintezei altor factori importanți considerăm în detaliu mecanismul sintezei căilor individuale ale moleculei de proteină din sistemul sintetizatoare artificial. În primul rând, folosind metoda izotopică, s-a descoperit că sinteza proteinelor începe la capătul N-terminal și se termină cu capătul C-terminal, adică procesul se desfășoară în direcția. NH2®COOH.
Sinteza proteinelor sau procesul de translație pot fi împărțite condiționat în două etape: activarea aminoacizilor și procesul de traducere efectivă.
A doua etapă a sintezei proteinelor matrice, traducerea efectivă, care se desfășoară în ribozom, este împărțită condițional în trei etape: inițierea, alungirea și terminarea.
Activarea aminoacizilor
O condiție obligatorie a sintezei de proteine, care în final se reduce la polimerizarea aminoacid este prezența în sistem nu este liber, și aminoacizi activate așa-numita, care posedă propria aprovizionare internă de energie. Activarea restului de aminoacid liber se realizează prin intermediul unor enzime specifice -tRNK sintetaze aminoacil în prezența ATP. Acest proces are loc în două etape:
Ambele etape sunt catalizate de aceeași enzimă. În prima etapă aminoacidul reacționează cu ATP și pirofosfat, și a format un produs intermediar, care într-o a doua etapă a reacționat cu 3 corespunzător ARNt ¢ -OH, formând astfel aminoacil AMP -tRNK și refulate. Aminoacil-ARNm are rezerva de energie necesară.
Amino acid este atașat la terminalul 3 ¢ -OH hidroxil-AMP, care, împreună cu două reziduuri constituie CMF terminalul CCA triplet fiind același pentru toate ARN de transport.
Procesele de traducere
inițiere Traducerea este un eveniment în care există complexul obrazovanie cuprinzând Met-tRNKimet, ARNm și ribozom undeva tRNKimet metionină tRNKV Acest proces implică cel puțin 10 factori de inițiere, care se face referire ca elful (din limba engleză. Factori de inițiere eucarioți) cu indicând numărul și litera. Inițial subunitatea 40S a ribozomului se leaga de inițiere factor care îl împiedică legarea la subunitatea 60S, dar stimulează asocierea cu un complex triplu, inclusiv Met-tRNKimet, FEI-2 și GTP. Apoi, acest lucru este acum din ce în ce mai complexe se leagă la ARNm 5'-terminal al implicării mai multor ELF. Unul dintre factorii de inițiere (ELF-4F) descoperă și se alătură secțiunii „capac“ pe molecula ARNm, astfel că a fost numit kepsvyazyvayuschego proteine. Atunci când sunt legați la ARNm, subunitatea 40S începe să alunece de-a lungul părții necodate a ARNm până la până când ajunge la codonul start secvență de codificare nucleotidică AUG. Alunecarea ARNm 40S subunitate este însoțită de hidroliza ATP, energia este cheltuită în depășirea porțiuni spiralate în porțiunea netranslatată a ARNm. În regiunile eucariote ARNm Klek necodificatoare sunt de lungimi diferite, dar este de obicei de la 40 până la 80 nucleotide, deși există zone cu o lungime de peste 700 de nucleotide.
La atingerea începutul secvenței care codifică mRNA, 40S oprește subunitatea și se leagă de alți factori de inițiere, accelerarea aderenței 60S subunitatea 80S ribozomilor și formarea datorită hidroliza GTP la PIB și fosfat anorganic. În această formă de A și P puncte de ribozomului, iar în F-centru este codon-ARNm cu august adjoint la acesta Met-tRNKimet.
Există 2 tARN-uri diferite în celulele care recunosc codonul AUG. Codonul de inițiere recunoaște tARN și tripletele mRNA care codifică includerea metioninei în regiunile interioare ale proteinei sunt citite de către un alt tRNA
La finalizarea inițierii ribozom ARNm localizat astfel încât centrul este o inițiere P-AUG codon cu atașat la acesta Met-tRNKimet. și A-center - triplet ce codifică proteina sintetizat pentru prima incorporare aminoacizi. Următoarea începe cea mai lungă fază de sinteza proteinelor - alungire, în timpul căreia ribozomului via aa-ARNt secvențial „se spune“ ARNm într-o triplete de nucleotide care urmează codonul de inițiere în 5 „la Z'-end, în creștere în lanț polipeptidic datorită secvential adăugarea de aminoacizi.
Includerea fiecărui aminoacid în proteină are loc în 3 etape, timp în care:
• aa-tARN al fiecărui aminoacid care intră în proteină se leagă de centrul A al ribozomului;
• peptida din peptidil-ARNt în centrul amplasat-P se alătură-NH2-Gruppe rest aminoacil aa-ARNt-centru pentru a forma o nouă legătură peptidică;
• prelungit cu un reziduu de aminoacizi de peptidil-ARNm se deplasează de la centrul A la centrul P, ca rezultat al translocării ribozomului.
Legarea aminoacil-tARN în centrul A. Codon mARN, situat în A-centrul lângă codonul start, definește natura aa -tRNKaa ¢ ¢, care vor fi incluse în A-Center. aa ¢ ¢ -tRNKaa interactioneaza cu ribozomului intr-un complex ternar compus din factorul EF-1 alungire, aa -tRNKaa ¢ ¢, și complexul GTP interacționează cu ribozomului eficient numai în cazul în care -tRNKaa anticodon aa ¢ ¢, komplimentaren și antiparalela cod ARNm în centrul A. Pornirea aa -tRNKaa ¢ ¢, ribozom apare datorită energiei hidrolizei GTP la PIB și fosfat anorganic
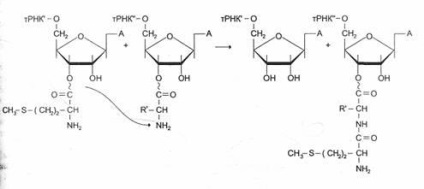
Formarea unei legături peptidice are loc imediat după eliminarea complexului EF-1 și GDF din ribozom. Această etapă a procesului se numește reacția de transpeptidare.
În timpul acestei reacții, restul metionină aa -tRNKaa ¢ ¢, se leagă la gruparea a-amino a primului aminoacid atașat la un Trnka ¢, iar în pacpolozhennoy se formează mai întâi legătura peptidică A-centru. Sa constatat că peptidiltrans | activitatea feraznaya a ARNr subunității mari ribozomale 28S face parte. Până acum au descoperit un grup de ARN având proprietățile enzimelor. Aceste ARN catalitic active sunt numite ribozomi se crede că ribozimele pot fi considerate „moaște“ din perioada timpurie a revoluției, atunci când proteinele nu au obținut încă o asemenea importanță ca și în perioadele ulterioare.
Translocația este a treia etapă de alungire. Factorul de alungire EF-2 este atașat la ribozom și, prin energia GTP, mișcă ribozomul de-a lungul ARNm la un codon la capătul 3 '. Ca rezultat, dipeptidil-tARN, care nu își schimbă poziția în ceea ce privește ARNm, se deplasează de la centrul A la centrul P. TARNaa fără metionină iese din ribozom și codonul următor intră în regiunea A-centru.
La sfârșitul celei de-a treia etape, alungirea ribozomului în centrul P are dipeptidil-tARN și tripletul care codifică includerea unui al doilea aminoacid în lanțul polipeptidic intră în centrul A. Se începe următorul ciclu al etapei de alungire, în timpul căruia evenimentele descrise mai sus trec din nou prin ribozom. Repetarea acestor cicluri în funcție de numărul de codoni semantici ai ARNm completează întreaga etapă de alungire.
Terminarea traducerii apare atunci când unul dintre codonii stop: UAG, UAA sau UGA intră în centrul A al ribozomului. Nu există tARN-uri corespunzătoare pentru codonii stop. În schimb, la ribozom sunt atașați doi factori de eliberare a proteinelor RF (de la limba engleza, eliberatori / actori) sau un factor de terminare. Unul dintre aceștia utilizează centrul peptidil transferazei pentru a cataliza scindarea hidrolitică a peptidei sintetizate din tARN. Altă datorită energiei de hidroliză a GTP provoacă disocierea ribozomului în subunități.
Interesant, factorii de traducere efecte datorate hidrolizei GTP realizează, sunt membri ai superfamiliei proteinelor G, care include G-proteine implicate in hormoni de transmitere a semnalului și alte substanțe biologic active și Ras proteinelor care funcționează ca factori de creștere. Toate proteinele G leagă și hidroliza GTP. Când acestea sunt conectate la GTP, activ și să participe la procesele metabolice relevante, iar când în situsul activ ca rezultat al hidrolizei GTP la PIB este convertit, aceste proteine devin conformație inactive.
Astfel, natura matricei a procesului de translație se manifestă prin faptul că secvența furnizării ribonomiei aminoacil-tRNA pentru sinteza proteinelor este determinată strict de ARNm, adică de ordinea dispunerii codonilor de-a lungul lanțului mRNA determină în mod unic structura proteinei sintetizate. Ribosomul scanează lanțul mRNA sub formă de tripleți și selectează secvențial "aa-tRNA" dorit "din mediul înconjurător, eliberând tARN deacilat în timpul alungirii.
Mici și mari subunitate ribozomale: procesul de traducere au funcții diferite: subunitatea mică a ARNm atașează decodifică informația folosind mecanismul translocație ARNt și subedanitsa mare responsabil pentru formarea legăturilor peptidice.
poliribozomilor
În timpul sintezei proteinelor, ribozomul este atașat la capătul 5 'al ARNm și se mișcă în direcția 3' a capătului. În acest caz, se eliberează capătul 5 'al mRNA și se poate uni un nou ribozom, pe care începe un alt lanț polipeptidic. De regulă, multe ribozomi participă simultan la sinteza proteinelor pe același mRNA, formând un complex numit polribozom sau polizom.
Fiecare ribozom ocupă un situs mRNA de aproximativ 80 nucleotide în lungime, deci ribozomii sunt localizați pe ARNm la intervale de aproximativ 100 nucleotide. Cu cât lanțul polipeptidic al proteinei sintetizate este mai lung, cu atât mai multe ribozomi pot sintetiza simultan această proteină, creând astfel în mod semnificativ eficiența utilizării matricei.
Fiecare ribozom este capabil să catalizeze formarea de legături peptidice de aproximativ 100 pe minut. Poliribozomilor pot exista sub formă de particule care plutesc în citoplasmă celulei, sau pot fi asociate cu ER. Particulele poliribosomnye citoplasmatice gratuite sunt responsabile pentru sinteza proteinelor care îndeplinesc funcții intracelulare. Poliribozomilor asociate cu ER, sub un microscop electronic, arata ca suprafata „dur“. Proteinele sintetizate „dur“ ER, să fie transportat prin membrana pentru a se asigura că au ajuns în poziția lor finală. Ele sunt caracterizate prin prezența pe capătul N-terminal al liderului sau semnal, lungimea secvenței de 15 până la 30 de resturi de aminoacizi, care conține mulți radicali hidrofobe de aminoacizi și permite trecerea proteinei prin membranele bistrat lipidic. Unele dintre aceste proteine sunt ambalate pentru transportul ulterior în granule secretoare Golgi.
Transportul proteinelor sintetizate prin membrane.
Sinteza proteinelor mitocondriale
In mitocondriile celulelor organismelor superioare conțin până la 2% din ADN-ul celular care diferă din miez de ADN. Mitocondriile conțin întregul aparat, inclusiv ribozomului, ARNt si MPH K necesar pentru sinteza anumitor proteine. Proteinele sintetizata in mitocondrii în principal insolubile sunt proteine implicate în organizarea structurii acestor organite, în timp ce sinteza sursei solubile de proteine mitocondriale sunt ribozomii citoplasmatici unde acestea sunt apoi transportate în mitocondrie. Ribozomii in mitocondriile sunt mai mici decât ribozomii 80S în citoplasmă. Interesant, ca inițiere aminoacid în sinteza proteinelor în mitocondrii eucariote pot fi implicate N-formilmetionină, nu metionina liberă ca în citoplasmă. Acest fapt indică faptul că sinteza de proteine mitocondriale în mecanismul său, evident, este aproape de sinteza proteinelor în procariote.
Modificări post-translaționale ale lanțului polipeptidic
Catentele lanțurilor pot fi supuse modificărilor structurale, fie în continuare legate de ribozomi, fie după terminarea sintezei. Aceste modificări structurale și structurale în lanțurile de polipeptide sunt numite modificări posttranslaționale. Acestea includ îndepărtarea unei porțiuni din lanțul polipeptidic, atașarea covalentă a unuia sau mai multor liganzi cu masă moleculară mică, obținerea unei conformații native de către proteină.
Multe modificări sunt efectuate în ER. Aici apare plierea lanțurilor de polipeptide și formarea unei structuri unice terțiară sau cuaternară a proteinelor. Și pentru a menține conformația nativă a moleculelor, formarea adecvată a legăturilor disulfidice este de mare importanță.
Proteoliza parțială
Multe proteine secretate din celule sunt inițial sintetizate ca molecule precursoare care sunt inactive funcțional. Eliminarea unei porțiuni a rezultatelor endoproteaza specifice lanțului de polipeptide în formarea de molecule active. Unele proteine precursoare sunt clivate in ER sau a aparatului; Golgi. altele - după secreție. Astfel, precursorii inactivi ai enzimelor secretate - zimogenele - formează enzima activă după scindarea anumitor porțiuni ale moleculei: pancreatice trypsinogen zimogen este transformat în tripsină activă după secreție
Articole similare
Trimiteți-le prietenilor: