Hidrogenarea și hidrogenarea distructivă - reacții de ordinul doi sub presiuni ridicate ale hidrogenului, randamentele de echilibru trec spre formarea compușilor saturați și hidrogenarea continuă aproape până la capăt. [C.141]
Rata de reacție în prezența catalizatorului este k [C02] [at], unde este caracteristica constantă pentru un catalizator dat și dependentă de temperatură și [la] este concentrația aditivului catalitic. Reacția are, astfel. prima ordine. În prezența unui ion sau a unei molecule care va reacționa cu ionul de hidrogen. (X, 2), hidratarea catalizată va continua până la atingerea echilibrului. Astfel, în prezența ionilor carbonați (și sub condiția unei presiuni de echilibru nesemnificativă a COa asupra soluției) ca urmare a reacției [c.243]

Acid fluorhidric (acid fluorhidric), acid fluorhidric în apă. Perimate. nume - acidul fluorhidric. În sistemul HF-H O, pot exista 3 conexiuni. NR NR (LEO P „), Hio-2HF (NRT + HF) și HJO-4HF, cu punct de topire la ryh resp. -36, -78 (dec.) Și -100 ° C t.-pl. amestec evtektich HJO -.... H2O -72 C pentru HF azeotrop (38,2% din greutate HF) p.f. 114,5 ° C. In toate formulările, non-azeotrop, FK evaporată incongruent presiunea vaporilor de echilibru. HF și N o ur descris mai sus FK-niem igp (Ha) = a - BIT, valori ale coeficienților, vezi tabelul [c.202] ...
Kinetica procesului de hidrocracare. Reacțiile de separare și izomerizare care apar în procesele de hidrocracare. sunt reacții tipice de ordinul întâi. Descompunerea hidrocarburilor este inhibată prin formarea de produse de scindare și o schimbare în condițiile de adsorbție [271,272,273]. Hidrogenarea și hidrogenarea distructivă, reacțiile de ordinul doi sub presiune ridicată a hidrogenului, randamentele de echilibru trec spre formarea compușilor saturați și hidrogenarea poate continua aproape până la sfârșit. Pentru a menține presiunea parțială necesară a hidrogenului, este necesar un exces considerabil, astfel încât etapele de hidrogenare bimoleculară să fie descrise prin ecuații pentru reacții pseudomonomoleculare. În acest fel. Majoritatea reacțiilor apărute în timpul hidrocracării trebuie să aibă o primă ordine. care este adevărat pentru scindare și izomerizare, și pare a fi evident pentru hidrogenare [274]. [C.245]
În mod similar, lucrarea privind traducerea a trei moli de hidrogen de la presiunea p2 la presiunea de echilibru este exprimată prin ecuația [c.196]
Pentru o evaluare vizuală a modului în care această valoare mică Kp stabilită arbitrar, ca metan și presiunea de echilibru hidrogen egal cu [c.146]
În consecință, între cantitatea de hidrogen adsorbită (sau gradul de acoperire de suprafață) și logaritmul presiunii hidrogenului de echilibru este o relație liniară [c.43]
Calculați presiunea de echilibru a hidrogenului fără a lua în considerare solubilitatea acestuia în titan. [C.229]
Pentru a măsura izotermele de adsorbție a gazelor pure în adsorbantul din cilindru printr-un rezervor tampon, gazul este pompat până la presiune - (1-2) -10 Pa (100-200 kgf / cm). După presiunea din adsorbtor, înregistrată de manometrul standard. gazul din adsorbant este descărcat lent, viteza gazului de ieșire de-a lungul reometrului este menținută constantă la 300 cm / min. Volumul exact al gazului eliberat este determinat în contorul de gaz. La anumite intervale, cantitatea de gaz eliberată și presiunea de echilibru în sistem sunt măsurate simultan. Restul gazului este evacuat din adsorbant prin hidrogen la presiune atmosferică. compoziția amestecului de ieșire este determinată de analizorul de gaz în ceea ce privește conductivitatea termică și cantitatea de adsorbant. eliberat prin suflare, se calculează prin integrarea grefei de ieșire. [C.167]
Dacă sursa de gaz inert conține 1% oxigen și 2,1% hidrogen, presiunea de echilibru de oxigen la 500 ° C egală cu 7-10 „2b la. Hidrogenul (fără impurități inerte), o presiune parțială de echilibru de oxigen mai mică. La 500 ° C și un conținut inițial de oxigen de 1%, este de 7-10 "32 la. Rezultatele calculului arată că până la 500 ° C pentru un amestec de compoziție stoechiometrică (N3 + ACP) și până la 1000 ° C, cu un ușor exces de hidrogen reacția hidrogenului cu interacțiunea oxigen poate fi considerată ca ireversibilă. [C.330]
Exemplul 13. La T = 693 K, hidrogenul și iodul sunt plasate într-un vas. Vasul este închis, reacția dintre hidrogen și iod are loc la V = onst. După stabilirea soldului. Se determină și / se obțin presiunile de echilibru ale reactivilor. = 0,007-10 n m = 0,300-105 n1m. Pf. = 0,32 -10 hJm. Calculați presiunea inițială H3 și h (n / m). [C.238]
Fiecare potențial poate fi atribuit presiunii de echilibru fictiv a hidrogenului în sistemul conjugat 2H20 / H2 [c.50]
Prin urmare, presiunea de echilibru a gazului A peste soluția pentru aceleași rpm este mai mică decât în absența transformării în soluție. Solubilitatea crește în mod corespunzător. Aceasta explică solubilitatea extrem de ridicată în apă a gazelor, cum ar fi acid clorhidric și amoniac. [C.38]

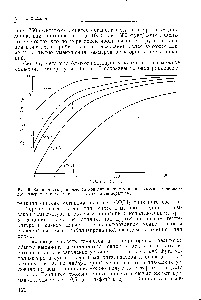
Procesul de formare a hidruri exotermice individuale, în funcție de presiunea și temperatura poate fi reprezentata de izoterma de presiune de echilibru. În Fig. 47 predst. Izoterme de presiune de echilibru pentru un număr de hidruri [71, 81, 81], din care urmează. că dacă presiunea de echilibru a hidrogenului crește, concentrația sa în aliaj crește. Când se atinge limita de solubilitate, poate apărea o nouă fază. pentru care, conform legii fazelor Gibbs, este caracteristică formarea unui platou de presiune. Transformarea întregului aliaj într-o hidrură primară (faza I) corespunde stoichiometriei fazei și unei creșteri intense a presiunii. Dacă aliajul poate forma oa doua fază (-faza), cum ar fi, de exemplu, PeT1 (figura 47, b), apare un alt platou de presiune. După care presiunea din nou crește brusc. [C.81]
Articole similare
Trimiteți-le prietenilor: