1. PRINCIPIUL MINIMULUI DE ENERGIE
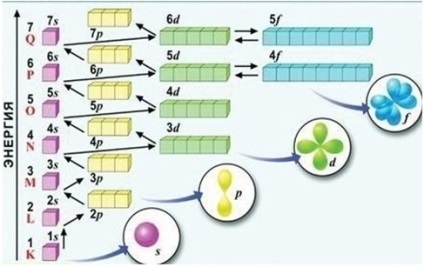
Orbitalele sunt umplute în ordinea cresterii energiei, de jos în sus. Fiecare electron este localizat astfel încât energia sa să fie minimă, adică între orbitele libere, alege orbitalul cu cea mai mică energie.
Ordinea de umplere a subsolurilor de energie (vezi Fig.) Pot fi memorate sub forma unei serii: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d » 4f <6p <7s….
2. PRINCIPIUL POLITIC
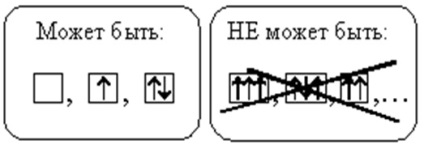
La fiecare orbital nu pot exista mai mult de doi electroni. Dacă doi electroni se află pe aceeași orbitală, atunci ei au rotiri opuse (săgețile indică direcții diferite). Astfel de electroni se numesc perechi. Dacă pe orbital există doar un electron, se numește nepereche.
3. REGULA HUNDA (GUNDA)
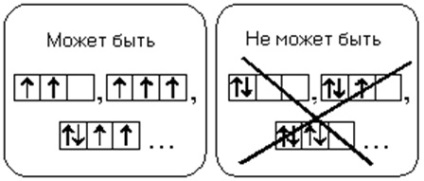
Un atom în starea solului trebuie să aibă un număr maxim posibil de electroni nepartiți într-o anumită subsol.
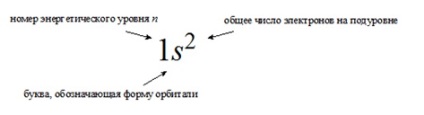
Formula electronică a unui atom este o înregistrare a distribuției electronilor asupra orbitalilor în starea de sol (neexpusă) a unui atom sau a ionilor săi
PRINCIPII DE CONSTRUCȚIE A CONFIGURĂRII ELECTRONICE A ELEMENTELOR
Numărul de electroni dintr-un atom al unui element este egal cu numărul său ordinal.
Numărul de nivele energetice ale unui atom este egal cu numărul perioadei în care este localizat elementul.
Numărul de electroni pe nivelul exterior (valența) este egal cu numărul grupului în care este localizat elementul.
Într-o descriere mai detaliată a configurației electronice, nu este luată în considerare numai numărul de electroni la un anumit nivel de energie, ci și distribuția lor pe podele. Orbitalul necompletat este notat cu un pătrat gol.
CONFIGURAREA ELECTRONICA A ATOMULUI
Configurațiile electronice detaliate ale atomilor sunt reprezentate în două moduri:
grafic, folosind pătrate cu săgeți (deseori denumite diagrame energetice);
în linie, atunci când toate subsilele de energie ocupate sunt enumerate cu o indicație a numărului total de electroni pe fiecare dintre ele.
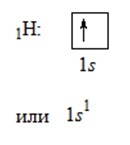
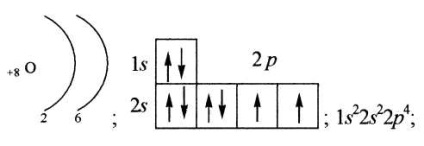
Valența unui atom este determinată de numărul de electroni nepartiți.
În prezența orbitalilor liberi, electronii atomului se pot deteriora, să sară la un alt subsol, adică atomul intră într-o stare excitată, deci valența poate fi constantă și variabilă. În acest caz, numărul de electroni nepartiți și, în consecință, numărul legăturilor formate de atom, crește.
Cea mai mare valență este întotdeauna egală cu numărul grupului (excepție: N, O, F).
Pentru a determina cea mai mică variabilă de valență (numărul de electroni liberi). care de cele mai multe ori au nemetalici, este necesar să se scadă numărul grupului de la 8.
Starea atomului, în care electronul de la perechea de electroni de la subsolul anterioară "se descompune" și se duce la următoarea subsol, se numește starea excitată a atomului.
Articole similare
-
Lecție integrată în fizică și chimie asupra structurii atomului
-
Soluția de sarcini tipice pe această temă - structura atomului și legătura chimică
Trimiteți-le prietenilor: