1. Medii nutritive naturale (rareori utilizate).
Mediile nutritive naturale sunt preparate pe baza soluțiilor de sare de Hanks și Earl, la care se adaugă serul, lichidul amniotic și extractul embrionic. Aceste fluide biologice sunt surse de nutriție proteică, vitamine și alte substanțe care promovează creșterea și multiplicarea celulelor. De exemplu, mediul pentru cultivarea celulelor HeLa: ser uman - 50%, extract de embrion de pui - 2%, soluție Hanks - 48%.
2. Produsele hidrolizate enzimatice ale substanțelor proteice.
Se adaugă hidrolizate enzimatice în mediu: lactalbumină, cazeină, proteine din sângele bovinelor.
3. Medii nutritive sintetice care diferă în compoziția complexă:
Mediu 199 (Parker) conține 20 de aminoacizi, 17 vitamine, purine și pirimidine, glucoză, 9 săruri minerale și o serie de alte substanțe. Acest mediu este preparat pe soluție de sare Hanks, sterilizat prin filtrare prin filtre bacteriene.
Mediul vultur conține 13 aminoacizi, 4 cationi, 3 anioni, 6 vitamine, colina, inozitol și carbohidrați.
1.2.2. Tipuri de culturi celulare
Pentru prepararea culturilor celulare se folosesc diferite țesuturi de animale, oameni și păsări, ambele embrionare și mature. În plus față de utilizarea normală și țesutul degenerat malign obținut din tumori.
Sursa de tesut embrionare este adesea embrion de pui si embrioni umani, șoareci, porci, iepuri, și alții. Embrionar și țesuturile tumorale au o mai buna de supravietuire si de crestere a mai active decât țesut adult. Din țesuturile mature cel mai des folosite țesuturi de rinichi (maimuțe, cobai, hamsteri etc.), membrana amniotică a unui bărbat.
Țesuturile sunt luate în condiții aseptice, spălate în soluție de sare Hanks și apoi supuse măcinării. În virologie, se folosesc numai culturi de țesuturi în creștere care sunt împărțite în:
1. Culturi de bucăți fixe de țesut.
2. Culturi celulare cu un singur strat:
a) culturi de celule primare;
b) culturi celulare transplantabile (stabile);
c) culturi de celule diploide.
3. Cultura celulelor suspendate.
În virologia practică, culturile cu un singur strat sunt folosite mai des. celulele care cresc și se înmulțesc atunci când sunt atașate la un substrat solid (sticlă, plastic), formând un strat cu grosimea unei celule (monostrat). Metoda de procesare a culturilor celulare unice se bazează pe tratamentul țesutului original cu enzime (de obicei, tripsină), care distrug legăturile intercelulare; Țesutul este dispersat și se formează o suspensie de celule izolate. Cand celulele cultivate sunt atașate la vasul de sticlă și să crească într-un monostrat continuu, permițând convenabil să lucreze pe celule prin infectarea lor cu viruși și vizual observa schimbarea care rezultă în dinamica.
a) Culturile de celule primare se pot reproduce numai în prima generație
Metoda de obținere a culturilor primare de fibroblaste de embrioni de pui
1. Ouăle incubate timp de 7-11 zile vor fi vitrate. După verificarea viabilității embrionului, se definește limita sacului de aer.
2. Învelișul de la capătul oțelului este șters cu alcool, iod, din nou cu alcool și apoi tăiat la nivelul airbag-ului.
3. Scoateți embrionul și puneți-l într-un vas steril, scoateți capul. Corpul embrionului este spălat cu 3-5 ml de soluție Hanks, care este apoi aspirat.
4. Corpul embrionului este măcinat cu grijă cu foarfece, piesele rezultate (aproximativ 1 mm3 în mărime) sunt pipetate într-un tub de testare.
5. Faceți spălarea de 2-3 ori a țesutului sfărâmat din sânge. De fiecare dată, se toarnă 2-3 ml de soluție într-un tub de testare cu o cârpă, se lasă țesuturile să se usuce și apoi lichidul este aspirat.
6. Se adaugă 3 ml de soluție de tripsină de 0,25% la țesutul spălat și se amestecă bine conținutul tubului cu pipetare (aspirare multiplă și suflare cu pipetă) sau agitare viguroasă. Sub acțiunea tripsinei, celulele țesuturilor se separă și formează o suspensie, astfel încât după ce particulele de țesut mai mari se așează pe fundul tubului, lichidul deasupra precipitatului trebuie să rămână tulbure.
7. Stratul de turbiditate superioară care conține suspensia celulelor izolate este transferat într-un tub de centrifugă, în care se pre-umple 2,5 ml de mediu de alimentare cu hidrolizat de lactalbumină. Se centrifughează la 1000 rpm timp de 10-15 minute.
8. Supernatantul este îndepărtat, se adaugă 2-3 ml hidrolizat de lactalbumină în peleta celulară și se amestecă bine, astfel încât celulele să fie suspendate din nou. Pentru a separa conglomeratele de celule care pot pătrunde în suspensie, se recomandă filtrarea ulterioară prin plasă din oțel inoxidabil sau tifon.
9. Numărarea celulelor în camera lui Goriaev se face sub o mică mărire a microscopului. După determinarea concentrației de celule în suspensie, se diluează cu hidrolizat de lactalbumină la 400.000 celule în 1 ml.
10. Șlamul este turnat în tuburi de 1 ml, acoperite cu dopuri din cauciuc și plasate într-un termostat la 37 ° C într-o poziție înclinată la un unghi de 50 ° C.
După 3-4 zile de la începutul culturii, se uită la tuburile la o mărire redusă a microscopului, puteți vedea alungite, celulele de proces - fibroblastele, care cresc pe peretele tubului pentru a forma un monostrat.
b) culturi celulare transplantabile (linii celulare)
Culturile celulare transplantate au un număr de avantaje față de celulele primare. Lucrul cu ei este mai puțin consumator de timp, acestea diferă într-o gamă largă de sensibilitate la numeroasele viruși. Cu toate acestea, culturile transplantate nu sunt potrivite pentru producerea de vaccinuri virale, deoarece există preocupări legate de posibilele malignități.
Culturile celulare transplantate, fără a se reintroduce într-un mediu proaspăt, degenerează destul de repede. Prin urmare, cultura celulară originală este cultivată în saltele cu un mediu nutritiv, replandu-se săptămânal cultura în vase noi. Atunci când se lucrează cu culturile de test, se recomandă re-sămânța acestora după 7-8 zile sau o dată la fiecare 3-4 zile pentru a înlocui mediul nutritiv cu proaspete, apoi culturile celulare își păstrează viabilitatea timp de 2-3 săptămâni.
Pentru cultivarea culturilor celulare continue utilizate mediu 199 (adesea suplimentat cu 10% ser bovin), mediu Eagle suplimentat cu 20% ser, 0,5% hidrolizat de lactalbumină, conținând ser de vițel 5%.
c) culturi de celule diploide
Acestea sunt numite culturi semi-transplantate, deoarece ini au capacitatea de a migra mult timp - pot suporta până la 40-50 de pasaje efectuate în perioada 8-10 luni. Apoi, cultura celulară se degenerează și se pierde. Diploid ele sunt numite, deoarece ele păstrează persistent cariotipul diploid, inerent celulelor normale originale ale corpului - strămoșii liniei diploide.
Culturile de celule diploide sunt obținute din diferite țesuturi ale embrionului uman, din culturi primare. De exemplu, tulpina DCHCH (celulele pulmonare diploide), tulpinile WJT-38, JMR-90, MRC-5 din țesutul pulmonar embrionar uman este cunoscută.
Culturile diploide sunt utilizate pentru izolarea și cultivarea virușilor. Ele sunt sensibile la multe tulpini de virusuri, sunt oncogene sigure, potrivite pentru cultivarea la scară industrială și pentru a obține o cantitate în masă de vaccinuri virale.
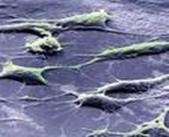
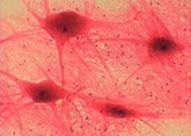
Fig. 2. Culturi celulare
Culturi de celule suspendate
Cultura suspendată este o cultură în care celulele individuale sau conglomeratele lor sunt suspendate în mod constant într-un mediu lichid.
Celulele în cultură în suspensie este posibilă obținerea, în cazul în care efectuează cultivarea sub agitare puternică constantă prin rotirea mediului în tuburi tambur cu un agitator magnetic, etc. Recent, utilizarea unor dispozitive speciale - .. chemostate în care este prevăzută o actualizare automată a mediului. Celulele suspendate au o activitate de creștere mai mare, se acumulează în cantități mari, iar înlocuirea obișnuită a mediului pentru o perioadă lungă de timp rămâne viabilă.
1.3. Cultivarea virușilor în dezvoltarea embrionilor de pui
Mulți viruși care infectează oamenii și animalele se pot reproduce mai mult sau mai puțin într-un embrion de pui. Prezența unei cochilii dense protejează embrionul de intrarea microorganismelor din mediul extern.
Metoda de cultivare a virușilor la embrioni de pui este utilizată în diagnosticul de laborator al infecțiilor virale, precum și pentru fabricarea vaccinurilor virale și a medicamentelor de diagnosticare. Dar această metodă are dezavantaje: 1) este imposibil de observat în dinamică spatele modificărilor patologice care apar în embrion după infecția cu virusul său; 2) la deschiderea virusului infecțios embrion nu este adesea detectabilă modificări vizibile și este necesar pentru a detecta prezența virusului în țesuturi într-un embrion fluide folosind alte metode virologice (de exemplu, reacția de hemaglutinare); 3) metoda de cultivare la embrioni de pui nu este potrivită pentru toți virușii. În ciuda deficiențelor, metoda este relativ simplă, convenabilă și ieftină și este utilizată pe scară largă în cercetarea virologică. Cea mai mare valoare pe care o are atunci când lucrează cu orthomixoviruses, herpesvirusuri, poxvirusuri.
1.3.1. Structura embrionului de pui
Embrionul de pui este acoperit cu o cochilie calcaroasă - o cochilie, la care se prăbușește o coajă de coajă din interior. La capătul bont al oului, se împarte și închide un spațiu de aer. Sub skorlupnoy shell este membrană corioalantoică în capătul bont al oului se trece de-a lungul interiorului skorlupnoy coajă, spațiul aerian de închidere, această coajă bogat în vase de sânge și servește de respirație a corpului embrionului. Din interior spre el se învecinează cavitatea alantoidă, care este organul de excreție și protejează embrionul de uscare și traume. Cavitatea alantoidă înconjoară embrionul situat în cavitatea amnionului, care este umplut cu lichid amniotic. Prin cordonul de gălbenuș, embrionul este conectat la sacul de gălbenuș - principala sursă de nutrienți.
anumite condiții de temperatură, necesare pentru cultivarea cu succes a virusurilor în organism de dezvoltare embrioni de pui (360-380), umiditate (50-70%), precum și o bună ventilație. Infect embrioni de pui de o anumită vârstă, de la incubat timp de 6 până la 13 zile, în funcție de tipul de virus metoda și infecție. Este necesar să se pregătească: ouă de palmier cu bule un alcool și iod, flaconul cu parafină sterilă, acoperă pahare, pungi de tifon steril și lână, învelite în hârtie recipient steril, seringi sterile, forceps, disecarea ac. Instrumentele plasate într-un pahar cu un alcool, în cazul în care acestea sunt în funcțiune pe tot parcursul, înainte de fiecare manipulare suplimentară sterilizate prin arderea lor într-o flacără lanternă. Mâinile înainte de începerea lucrărilor se spală bine, se recomandă să poarte o mască de tifon.
Pentru muncă sunt selectați embrioni viabili, care radiază ouăle incubate în ovoscop. Embrionul viabil este mobil, vasele de sânge ale cochiliei sunt umplute cu sânge. Ouăle selectate sunt dezinfectate temeinic la capătul bont (sau pe partea oului): coaja este ștersă cu alcool, pătată cu iod, re-tratată cu alcool și arsă.
1.3.2. Infecția unui embrion pui cu o membrană chorionallantoică
Embrionii de pui cu vârsta între 10 și 12 zile sunt utilizați pentru infecție. Principalele etape ale infecției:
1. Așezați oul pe suport într-o poziție verticală, astfel încât airbag-ul să fie în partea superioară, sterilizați cochilia pe capătul bont al ouălui.
2. Deasupra centrului airbagului, perforați carcasa cu un ac disecant.
3. În gaura rezultată este introdusă o maxilară de foarfece și o fereastră inshell este tăiată cu diametrul de 1,5 cm.
4. Prin gaură, rupeți ușor coala interioară a carcasei cu un ac și desprindeți-o într-o zonă mică (0,5-1 cm2).
5. Contaminarea membranei coronarylantoice se face prin aplicarea a 0,1-0,2 ml de material care conține virus, folosind o pipetă Pasteur sau o seringă.
6. Fereastra inshell este închisă cu o peliculă elastică specială sau o alunecare sterilă și fixată cu parafină topită.
Embrionii infectați sunt plasați într-un termostat într-o poziție verticală și incubați timp de 2-3 zile, după care se efectuează o autopsie conform următoarelor reguli:
1. Oul este așezat pe suport astfel încât spațiul de aer să fie în partea de sus, sterilizarea locului de deschidere este efectuată.
2. Foarfecele sterile taie coaja de-a lungul limitei spațiului aerian.
3. Folosind o pereche de pensete, îndepărtați carcasa de coajă de-a lungul marginii. Membrana corionallantoiză expusă este tăiată de-a lungul marginii cochiliei. Prin gaura formată, tot conținutul oului este turnat în ceașcă sau în tava.
4. Învelișul chorionaleantoic rămas din interiorul cocii este extras cu atenție cu ajutorul forcepsurilor și introdus într-un vas steril cu soluție salină. Aici, ei se îndreaptă și studiază schimbările, plasând paharul pe fundal întunecat.
Datorită volumului mare, acest material este plasat pe mai multe pagini:
1 2 3
Articole similare
Trimiteți-le prietenilor: