Dacă lăsăm placa de zinc în soluția de sulfat de cupru, atunci reacționăm
Reacția eliberează căldura (Q). Asta înseamnă că energia chimică va intra în căldură. Este posibilă conversia energiei chimice în energie electrică.
Celula galvanică este un dispozitiv în care energia chimică a reacției de reducere a oxidării este transformată în energie electrică.
Principala diferență dintre reacțiile electrochimice care au loc într-o celulă galvanică și reacțiile de reducere a oxidării este separarea spațială a proceselor de oxidare și de reducere.
Cea mai comună este o celulă galvanică formată din doi electrozi interconectați. care sunt plăci metalice scufundate în soluția electrolitică (soluții sau topiri de săruri cu ionul cu același nume).
Luați în considerare funcționarea celulei electrochimice Daniel Jacobi (Figura 9.5.1.), Format din doi electrozi - o placă de zinc, cufundat într-o soluție de sulfat de zinc și o placă de cupru, cufundat într-o soluție de sulfat de cupru. Ambele soluții sunt în contact unul cu celălalt, dar pentru a preveni amestecarea, ele sunt separate printr-o perete despărțitor realizat dintr-un material poros.
Atunci când un circuit deschis în celula electrochimică se stabilește un echilibru între electrodul de zinc și o soluție de sulfat de zinc și între electrodul de cupru și soluția de sulfat de cupru. Când circuitul extern este închis, electronii se deplasează de la electrodul cu un potențial mai mic (zinc) la un electrod cu un potențial mai mare (cupru).
Electrodul de zinc este urmat de o reacție de oxidare și ionii sunt transferați în soluție. Electronii eliberați în acest proces se deplasează de-a lungul circuitului extern către electrodul de cupru. Totalitatea acestor procese este reprezentată schematic prin ecuația reacției primului semestru
Ionii de cupru sunt recuperați pe electrodul de cupru: electronii care s-au mutat la el de la electrodul de zinc sunt conectați la ionii de cupru din soluție; se formează atomi de cupru, care sunt eliberați în forma elementară pe placa metalică. Reacția a doua jumătate corespunzătoare -
Cu 2+ + 2e - = Cu 0.
Ecuația generală a reacției care apare în element este obținută prin adăugarea ecuațiilor celor două jumătăți de reacție
Cu 2+ + 2e - + Zn 0 - 2e - = Zn 2+ + Cu 0.
Direcția de mișcare a ionilor în soluție se datorează proceselor electrochimice care au loc la electrozi. După cum sa menționat mai sus, cationii electrod de zinc (ioni pozitivi), situat în soluție, creând în ea o sarcină pozitivă în exces, în timp ce soluția electrod de cupru, prin contrast, tot timpul sărăcită cationii și încărcate negativ. Ca rezultat, un câmp electric, în care cationii (Zn2 + și Cu2 +), trecerea de la electrodul de zinc la cupru, și anioni - SO4 2- - în direcția opusă. Ca urmare, lichidul celor două electrozi rămâne neutru din punct de vedere electric.
Cauza apariției și a fluxului de curent electric în celulă este diferența dintre potențialele electrodului - forța electromotive (EMF). EMF a oricărei celule galvanice este egală cu diferența de potențial dintre cei doi electrozi (catod și anod):
unde Ek este potențialul electrodului catodului; Ea este potențialul de electrod al anodului. EMF a oricărei celule galvanice de lucru este o cantitate pozitivă.
Anodul este electrodul pe care are loc procesul de recul de electroni (oxidare); În celula galvanică, anodul este încărcat negativ. Catod - electrodul pe care are loc procesul de îmbinare a electronilor (restaurare); în celula galvanică, catodul este încărcat pozitiv.
Potențialul catodic este mai mare decât potențialul anodic, respectiv, în elementul cupru-zinc, electrodul de zinc este anodul și electrodul de cupru este catodul.
Pentru elementul Daniel-Jacobi în condiții standard și la [Zn 2+] = [Cu 2+] = 1 mol / l
deci EMF = V.
Circuitul unui circuit al unei celule galvanice este scris în formă
(-) Zn | Zn 2 + || Cu 2+ | Cu (+)
Anodul este înregistrat în stânga, iar catodul este în partea dreaptă. O bară verticală reprezintă separarea fazelor dintre metal și soluția de electroliți. O linie verticală dublă separă spațiul anodic de catod. În paranteze semnele "plus" și "minus" reprezintă polii electrozilor.
Celula galvanică de concentrare este o celulă galvanică metalică formată din doi electrozi identici, imersați în soluții ale sărurilor lor cu concentrații diferite. De exemplu, o celulă placată cu argint
Aici, electrodul stâng cu o concentrație mai mică este anodul, iar electrodul drept cu o concentrație mai mare este catodul.
În unele cazuri, metalul electrodului nu suferă modificări în timpul procesului de electrod, ci participă doar la transferul electronilor din forma redusă a substanței în forma sa oxidată. Deci, într-o celulă galvanică
(-) Pt | Fe +2. Fe +3 || MnO4 -. Mn +2. H + | Pt (+)
Rolul electrozilor inerți este jucat de platină. Fierul (II) este oxidat pe anodul de platină:
și pe catodul de platină, manganul (VII) este redus:
Înmulțind prima dintre aceste ecuații cu cinci și adăugând cea de-a doua, obținem ecuația totală a reacției procesuale:
5Fe + 2 + MnO4 - + 8H + = 5Fe + + Mn + 2 + 4H2O.
Conform ecuației 9.3.3. este posibil să se calculeze potențialul electrodului și, în consecință, EMF a celulei galvanice rezultate.
Electroliza este un proces de reducere a oxidării care are loc pe electrozi când un curent electric direct trece prin soluții sau topiri de electroliți. electroliza esență constă în faptul că atunci când un curent prin soluția de electrolit (sau electrolit topit) cationi sunt deplasate la electrodul negativ (catod), anioni și - la un electrod pozitiv (anod). După ce au ajuns la electrozii, ionii sunt evacuați, ca rezultat al eliberării de la electrozii a componentelor electrolitului dizolvat sau a hidrogenului și a oxigenului din apă. În timpul electrolizei se desfășoară două procese paralele: la catod (încărcat negativ) procesul de reducere; pe anod (încărcat pozitiv) - procesul de oxidare. Astfel, încărcăturile electrozilor în timpul electrolizei sunt opuse celor care apar în timpul funcționării unei celule galvanice.
Natura și fluxul proceselor electrodului în timpul electrolizei sunt puternic influențate de compoziția electrolitului, solventului, materialului electrozilor și regimului de electroliză (tensiune, densitate de curent, temperatură etc.). În primul rând, este necesar să se facă distincția între electroliza electroliților topiți și soluții.
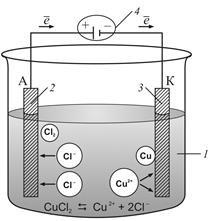
Fig. 9.6.1. Schema de electroliză a topiturii de CuCl2. 1 - topirea sarii CuCI2; 2 - anod; 3 - catod; 4 - sursă constantă de curent
Electroliza topiturilor de săruri. Luați în considerare, de exemplu, electroliza topiturii de clorură de cupru (Figura 9.6.1). La temperaturi ridicate, topitura de sare se disociază în ioni. Atunci când se conectează electrozii la o sursă de curent continuu, ionii sub acțiunea unui câmp electric încep mișcarea ordonată: ionii pozitivi de cupru se deplasează la catod și ionii încărcați negativ de clor - către anod.
După atingerea catodului, ionii de cupru sunt neutralizați de electronii în exces ai catodului și transformați în atomi neutri depuși pe catod:
Ionii de clor, ajungând la anod, dau pe electroni și formează molecule de clor Cl2. Clorul este eliberat la anod sub formă de bule:
Ecuația totală a reacției de oxidare-reducere care are loc în timpul electrolizei topiturii de CuCl2:
Cu + 2 + 2CI -> Cu 0 +.
Electroliza soluțiilor apoase de săruri. În soluțiile apoase, pe lângă ionii electrolitului în sine, există și molecule de apă care pot fi reduse pe catod și oxidate la anod.
Procese pe catod. Posibilitatea de reducere a ionilor metalici sau a moleculelor de apă este determinată de valoarea potențialului electrodului metalului, precum și de natura mediului (pH). În cazul general (fără influența naturii mediului), pot apărea următoarele procese la catod (Tabelul 9.6.1):
1) dacă sarea metalului activ este supusă electrolizei, moleculele de apă sunt restaurate pe catod. Ca rezultat, hidrogenul este eliberat din catod;
2) dacă sarea unui metal activ mediu este supusă electrolizei, are loc o reducere simultană a cationilor metalici și a moleculelor de apă;
3) dacă sarea unui metal slab activ este supusă electrolizei, numai cationii metalici sunt reduse pe catod.
Articole similare
Trimiteți-le prietenilor: