Constanta de timp
Capacitate în cablu
Sensibilizare și S interneurons
Capacitatea membranei
Membrana celulară nu numai că conduce curenți ionici, ci acumulează și o încărcătură pe suprafața exterioară sau interioară. Din punctul de vedere al teoriei electricității, separarea sarcinilor pe membrană înseamnă că membrana are proprietățile unui condensator. În general, condensatorul constă din două plăci conductoare separate unul de altul printr-un material izolator; La condensatoarele industriale, plăcile conductoare sunt de obicei realizate din folie metalică, iar stratul izolator dintre acestea este realizat din plastic. În cazul unei celule nervoase, două straturi de lichid sunt situate pe ambele părți ale membranei, iar membrana acționează ca un strat izolator. La încărcarea condensatorului din baterie, una dintre plăci acumulează o încărcare pozitivă, în timp ce pe a doua placă se creează o încărcare negativă egală. Condensatorul (C) este determinată de cantitatea de încărcare (Q), capacitate per volt stocare (V), aplicată plăcilor condensatorului: C = Q / V. C este măsurat în coulombii împărțiți la volți, adică în faradele (F). Plăcile mai apropiate sunt una cu cealaltă, cu atât mai eficient capacul este capabil să separe și să acumuleze încărcătura. Deoarece grosimea membranei celulare este de numai 5 nm, este capabilă să acumuleze o încărcare suficient de mare. În mod tipic, capacitatea membranei celulelor nervoase este de 1 μF / cm2. Conversia expresiei obținem Q = CV. Când repaus potențial de -80 mV, cantitatea de sarcină negativă în exces pe partea interioară a membranei este (1 x 10 -6) x (80 x 10 -3) = 8 × 10 -8 coulomb împărțit la 2 cm, care corespunde la 5 x 10 noiembrie ioni monovalenți (0,8 pmol) pe centimetru pătrat al membranei.
Mărimea curentului care curge în interiorul sau în exteriorul condensatorului poate fi calculat pe baza raportului de încărcare-tensiune, având în vedere că curentul (i, în amperi) este viteza de schimbare a încărcăturii în timp, adică 1 amp = (1 pendant) / (1 s). Deoarece Q = C / V, obținem:
Rata de schimbare a sarcinii pe condensator este direct proporțională cu magnitudinea curentului. Dacă curentul este constant, atunci potențialul va varia cu o viteză constantă dV / dt = i / C.
Raportul de curent și tensiune într-un circuit care conține rezistențe (rezistențe) și condensatoare (condensatoare) conectate în paralel. Un salt rectangular al curentului i atașat la rezistor (R) creează un salt de tensiune peste rezistența lui V = iR. Dacă același salt curent atașați la condensator (C), tensiunea pe condensator va acumula la o rată dV / dt = i / C. Când aceste două elemente, un rezistor și un condensator conectat în paralel, curentul curge întreg mai întâi la condensatorul de încărcare la o rată i / C; Cu toate acestea, de îndată ce un condensator se acumulează o sarcină, curentul va curge prin rezistor. Odată cu creșterea curentului, din ce în ce mai mult va trece prin rezistență, deoarece viteza de încărcare a condensatorului va scădea treptat. În cele din urmă tot curentul va curge prin rezistor, creând un potențial V = iR pe el, iar condensatorul va fi complet încărcat. La sfârșitul sarcinii actuale, sarcina de la condensator se va disipa treptat pe rezistor, iar tensiunea va reveni la zero. Din experimente pe axon squid poate concluziona că ipoteza exprimată de Bernstein în 1902 a fost aproape de adevar: gradientul transmembranar de potasiu este un important, deși nu singurul factor care afectează potențialul de membrană. Cum poate fi explicată abaterea curbei experimentale din ecuația Nernst? Se pare că pentru aceasta este suficient să se elimine restricția din model, constând în faptul că membrana este impermeabilă la ionii de sodiu. Membrana unei celule reale nu are permeabilitate la sodiu, care este de la 1 la 10% potasiu.
Pentru a lua în considerare rolul permeabilității sodice, să ne îndreptăm spre modelul unei celule ideale și să excludem temporar mișcarea ionilor de clor din câmpul vizual. Potențialul de membrană egală cu potențialul de echilibru de potasiu, astfel încât deplasarea sarcină netă prin membrana este absent, celula este în repaus. Dacă permeabilitatea la sodiu este acum introdusă în model, sodiul se va strădui să intre în celulă datorită atât gradientului său de concentrație, cât și potențialului membranei. Deoarece sodiul intră pe suprafața interioară a membranei, se acumulează o sarcină pozitivă, iar membrana se depolarizează. Ca urmare, ionii de potasiu sunt în afara echilibrului și încep să părăsească celula. Deoarece depolarizarea membranei crește, forța motrice pentru admisia de sodiu scade, în timp ce forța motrice pentru randamentul de potasiu crește. Procesul continuă până când ambele fluxuri de ioni se echilibrează. În acest moment, schimbarea potențialului membranei încetează, deoarece nu există acumulare de încărcătură. În general, potențialul de membrană este dispus între sodiu și potasiu echilibru potențial și este determinată de echilibrul dintre curenții de potasiu și sodiu egale în mărime și îndreptate în direcții opuse.
ioni de clor sunt de asemenea implicate în acest proces, cu toate acestea, așa cum am văzut mai devreme, potențialul de echilibru pentru clor adaptează la noua valoare a potențialului de membrană datorită modificărilor concentrației intracelulare a acestui ion. Pe măsură ce curenții de cationi trec treptat în echilibru, nivelul intracelular de clor crește până când clorul total devine zero.
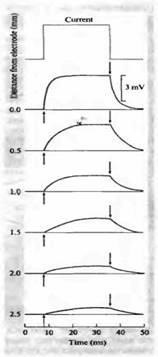
Fig. 1. Propagarea potențialului de-a lungul axonului homar, înregistrat cu ajutorul unui electrod de suprafață.
Constanta de timp
Creșterea și descompunerea potențialului are loc pe o curbă exponențială, așa cum se arată în Fig. 1B. Faza de creștere este descrisă de ecuația:
unde t este timpul de la începutul pulsului. Constanta de timp este egala cu produsul RC. Acesta este momentul în care potențialul crește până la 63% (1 - 1 / e) din valoarea maximă. Căderea de tensiune este, de asemenea, exponențială, cu aceeași constantă de timp. Curentul prin rezistor, iR. trebuie să varieze în timp, în conformitate cu aceeași lege ca tensiunea. În consecință, în faza de creștere, curentul începe să crească de la zero la valoarea sa maximă i. Curentul capacitiv, dimpotrivă, începe cu valoarea i și scade la zero exponențial cu aceeași constantă de timp. La sfarsitul pulsului, deoarece nu exista o sursa de energie externa, singurul curent pe rezistor este curentul generat de tensiunea pe condensator. În consecință, curentul de pe rezistor este egal cu valoarea curentului capacitiv și este opus față de acesta în direcție, așa cum se arată în figură.
Circuitul descris mai sus care constă dintr-un rezistor conectat în paralel și condensator, poate fi folosit pentru a descrie sferice axonilor și dendritelor celulelor nervoase, care sunt atât de mici încât acestea să contribuie la proprietățile electrice ale celulelor pot fi neglijate. Într-un lanț echivalent pentru axon sau fibră musculară, atât capacitatea membranei cât și rezistența acesteia sunt distribuite de-a lungul întregii lungimi a fibrei, așa cum se arată în Fig. 7.2D. Membrane capacitate pe unitatea de lungime, cm (măsurată în microfarazi / cm) depinde de capacitatea specifică pe unitatea de suprafață Cm (în microfarazi / cm2) cu formula Cm = 2ST. unde este raza fibrei.
Constanta de timp a membranei unei celule sferice sau fibre nu depinde de dimensiunea celulei sau a fibrei. Motivul pentru aceasta este că o creștere a razei (și, în consecință, a suprafeței membranei) implică nu numai o creștere a capacității, ci și o scădere corespunzătoare a rezistenței, astfel încât produsul celor două cantități să nu se modifice. Deoarece se arată că valoarea Cm este aproximativ aceeași pentru toate fibrele nervoase și musculare (1 μF / cm2), valoarea # 964; este un parametru convenabil care caracterizează rezistența specifică a membranei pentru o anumită celulă. Constanta de timp este al treilea parametru care, impreuna cu rezistenta de intrare si lungimea constanta, caracterizeaza comportamentul axonului. Intervalul de valori ale constantei de timp în diferite tipuri de celule nervoase și musculare este cuprins între 1 și 20 ms.
Capacitate în cablu
Care este efectul constantei de timp asupra curentului în cablu? Ca și în cazul unei simple RC-lanț (Fig. 1C), creșterea potențială și scăderea ca răspuns la schimbarea bruscă a curentului încetinește datorită prezenței condensatorului. Situația este complicată de faptul că curentul curge prin mai un condensator, dar fiecare segment de lanț este unul dintre elementele rezistiv-capacitiv care interacționează între ele. Din cauza acestor interacțiuni, cursul timpului într-un segment separat nu poate fi descris printr-o fază de creștere exponențială simplă și sunt încetinit și cad ca distanța de la punctul curent de injecție (fig. 2). Deoarece rata de creștere a potențialului depinde de distanța dintre electrodul de descărcare și site-ul curent al injecției, constanta de timp dezintegrare nu poate fi calculat pe baza unei simple de măsurare a timpului 63% creștere potențială de sodiu, cu excepția unui singur punct de-a lungul fibrei, în care distanța este egală cu o lungime constantă.
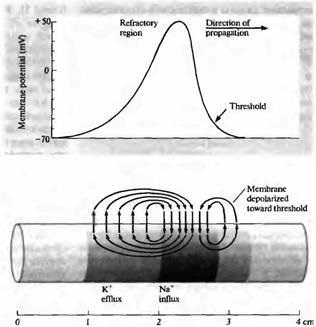
Să luăm în considerare mișcarea ionilor. Dacă în axon se injectează un curent pozitiv, ionii intracelulari (în principal potasiul) se vor propaga de-a lungul fibrei. Unele dintre ioni vor merge pentru a schimba încărcarea pe capacitatea membranei, cealaltă parte va curge prin rezistența membranei. Simultan cu acest proces, ionii negativi se vor mișca în direcția opusă. Treptat, potențialul de pe membrană va atinge o nouă valoare stabilă, capacitățile distribuite pe membrană vor fi complet încărcate la un nou nivel de potențial și un curent constant de ioni va curge prin membrană. Timpul necesar pentru a atinge o stare stabilă nouă este determinat de constanta de timp.
Fig. 2. Curentul membranei în timpul trecerii potențialului de acțiune.
Sensibilizare și S interneurons
Mecanismul de modul în care un neuron individ poate juca un rol în coordonarea comportamentului animalelor cu atenție și cu insecte și crustacee, în care au fost descrise separat neuronii „comandă“, capabile de a conduce o orchestra de comportament organism întreg. În leech, acest rol este jucat de interneuronul neparat prezent în fiecare ganglion și numit celula S. Acest neuron primește impulsuri incitante din celulele sensibile la atingere și presiune și, la rândul său, stimulează motoneuronul L, ceea ce contribuie la contracția corpului (așa cum a fost indicat anterior). Fiecare celulă S este conectată la celula S a segmentelor adiacente prin intermediul unui axon gros cu o viteză ridicată de conducere printr-o sinapsă electrică. Faptul că sinapsă se află în mijloc între segmente poate fi determinată prin introducerea unei peroxidaze de hrean în S, care nu se poate răspândi prin intersecțiile gap.
Lanțul secvențial al celulelor S este mecanismul-cheie al reacțiilor adaptive la leech. Cu stimularea tactilă repetată prin atingerea unui anumit segment al corpului, apare mai întâi un reflex de contracție. Răspunsul devine mai slab și mai slab la fiecare atingere următoare - acest efect este cunoscut ca "obișnuință". Cu toate acestea, după o stimulare mai puternică, când este activată # 929; (presiunea) și N (durerea) celulei, răspunsul la stimularea suplimentară a celulelor T (atunci când este atins) devine din nou vizibil. Acest proces este cunoscut sub numele de „înțărcare» (dishabituation) În același mod, în cazul în care un stimul mai puternic se aplică la «procedura de formare», provoacă o sensibilizare, t. E. Răspunsul la stimulare atunci când este atins va fi mai obișnuită. Celulele S active în timpul „acomodării“ este neschimbată, dar crește ca în sensibilizarea și la „înțărcare“ dificili tehnic Experimentele fezabile atunci când selectiv este tăiat celule axon S, sau celulele sunt sacrificate prin injectare pronazei, procesele de „obișnuinței“ și reducerile nu sunt schimbate , cu toate acestea, dispărând complet "retragerea" și sensibilizarea.
Într-o a doua serie de experimente, axonii cu celule S au fost deteriorați pentru a examina regenerarea lor. Proprietatea uimitoare a celulelor S este că, după leziuni, axonii lor urmează calea veche și reconstituie conexiunile electrice cu neuronul S învecinat cu o precizie extraordinară. După cum era de așteptat, o întrerupere a transferului de impulsuri între celulele S între segmente individuale a dus la dispariția sensibilizării, dar la câteva săptămâni după regenerarea completă a axonilor și restabilirea conexiunilor anterioare, această proprietate a fost, de asemenea, restaurată.
Aceste exemple demonstrează în mod clar modul în care o celulă nervoasă individuală este capabilă să participe la un proces comportamental atât de complex precum sensibilizarea. Sa constatat că, de fapt, procesele de sensibilizare se datorează, în mare parte, serotoninei. (O serie neobișnuită de coincidențe a contribuit la faptul că celula S numele «“ a fost foarte potrivit pentru aceste celule. Inițial, acesta a fost numit astfel pentru ca impulsul ei formează un impuls lung (vârf) în contact. Apoi, a constatat ca aceste celule sunt foarte strâns legate unii cu alții, au crezut că acestea ar putea fi sincițiu. acum, ei sunt numite celule S de la cuvintele „sensibilizare“ și „serotonină“!) în procesul Aplysia de sensibilizare (în care serotonina joaca un rol important) a fost studiat foarte atent atât la celular, și la nivel molecular).
Semnalele scurte se propagă la distanțe mai scurte decât semnalele lungi. În cazul unei durate suficiente a semnalului, în timpul căreia potențialul atinge valoarea maximă, capacitatea este complet încărcată, iar distribuția spațială a potențialului este determinată de rezistența membranei și a citoplasmei: Vx = V0 # 949; -x /. Pentru impulsuri scurte, cum ar fi potențialul sinaptic, curentul se oprește înainte ca condensatorul să aibă timp să se încarce complet. Aceasta se exprimă prin scăderea distanței pe care potențialul se propagă de-a lungul fibrei. Cu alte cuvinte, constanta lungimii efective pentru semnalele scurte este mai mică decât pentru semnalele lungi. În plus, forma semnalelor scurte este distorsionată atunci când se deplasează de-a lungul fibrei și amplitudinea lor este redusă prin "rotunjirea" vârfului atins mai târziu și ulterior
1. Penrose R. NOUL MINIM al regelui. Pe calculatoare, gândire și legile fizicii.
2. Gregory RL O vedere rezonabilă.
3. Lekakh VA Cheia înțelegerii fiziologiei.
4. Gamow G. Inch M. Domnul Tompkins în sine: Aventuri în noua biologie.
Articole similare
-
Unele proprietăți fizice și parametrii membranelor - stadopedia
-
Rezistență - membrană - o enciclopedie mare de petrol și gaze, articol, pagina 1
Trimiteți-le prietenilor: